新年号特集 免疫の謎を解き明かす カラー解説
マウスとヒトの知見が交差する免疫学
寄稿 藤尾 圭志
2026.01.13 医学界新聞:第3581号より
免疫系は本来,外来の病原体を排除し生体の恒常性を保つよう機能している(図1)。しかし,免疫系が自己抗原に過剰に応答すれば自己免疫疾患が惹起され,逆に応答が不十分であればがん細胞の増殖につながるなど,その機能異常はさまざまなヒト疾患を引き起こす。こうした病態は免疫介在性疾患と呼ばれ,免疫担当細胞の多様な応答により,複雑な臨床的表現型を呈する。これらの疾患の病態解明および創薬には免疫系の理解が不可欠である。これまではヒトとの免疫系の類似性を背景にマウスを用いた研究が免疫学の発展に大きく貢献してきた一方で,近年の技術進歩によって,ヒト検体を用いたゲノム・エピゲノム・トランスクリプトーム解析と,それらを統合したマルチオミクス解析が可能となり,ヒト免疫や免疫介在性疾患のさらなる解明が進む。マウスモデルは依然として重要な研究手段であるが,マウスとヒトの免疫系には本質的な違いも存在することから,マウスとヒトの双方向的な比較解析を通じた免疫学の再構築が求められている。
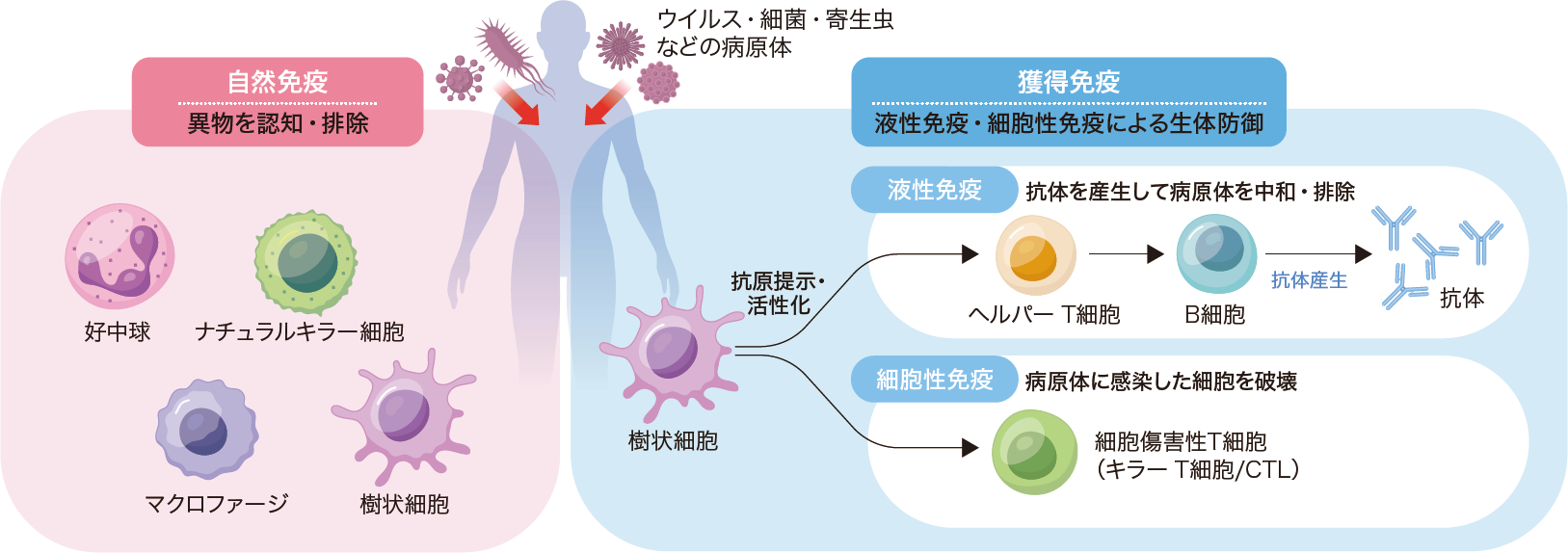
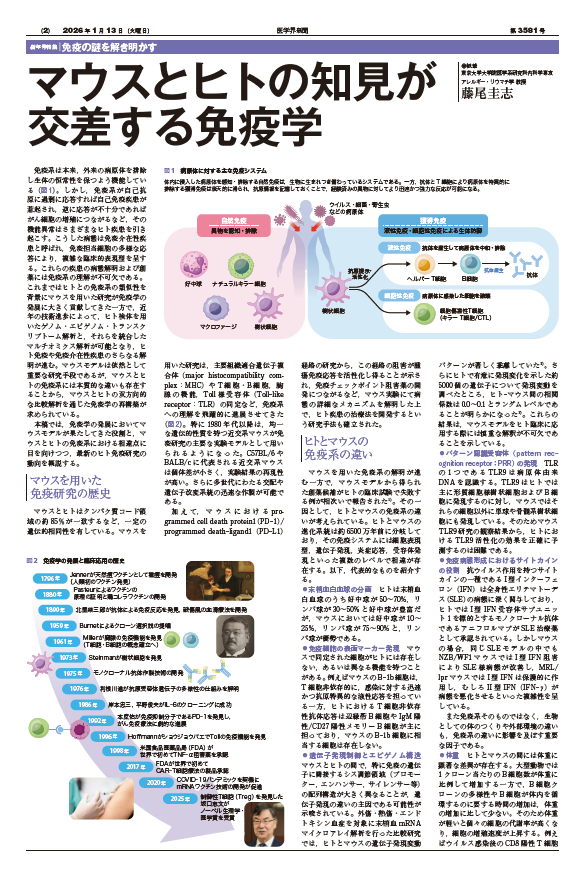
体内に侵入した病原体を感知・排除する自然免疫は,生物に生まれつき備わっているシステムである。一方,抗体とT細胞により病原体を特異的に排除する獲得免疫は後天的に得られ,抗原情報を記憶しておくことで,経験済みの異物に対してより迅速かつ強力な反応が可能になる。
本稿では,免疫学の発展においてマウスモデルが果たしてきた役割と,マウスとヒトの免疫系における相違点に目を向けつつ,最新のヒト免疫研究の動向を概説する。
マウスを用いた免疫研究の歴史
マウスとヒトはタンパク質コード領域の約85%が一致するなど,一定の遺伝的相同性を有している。マウスを用いた研究は,主要組織適合遺伝子複合体(major histocompatibility complex:MHC)やT細胞・B細胞,胸腺の機能,Toll様受容体(Toll-like receptor:TLR)の同定など,免疫系への理解を飛躍的に進展させてきた(図2)。特に1980年代以降は,均一な遺伝的性質を持つ近交系マウスが免疫研究の主要な実験モデルとして用いられるようになった。C57BL/6やBALB/cに代表される近交系マウスは個体差が小さく,実験結果の再現性が高い。さらに多世代にわたる交配や遺伝子改変系統の迅速な作製が可能である。
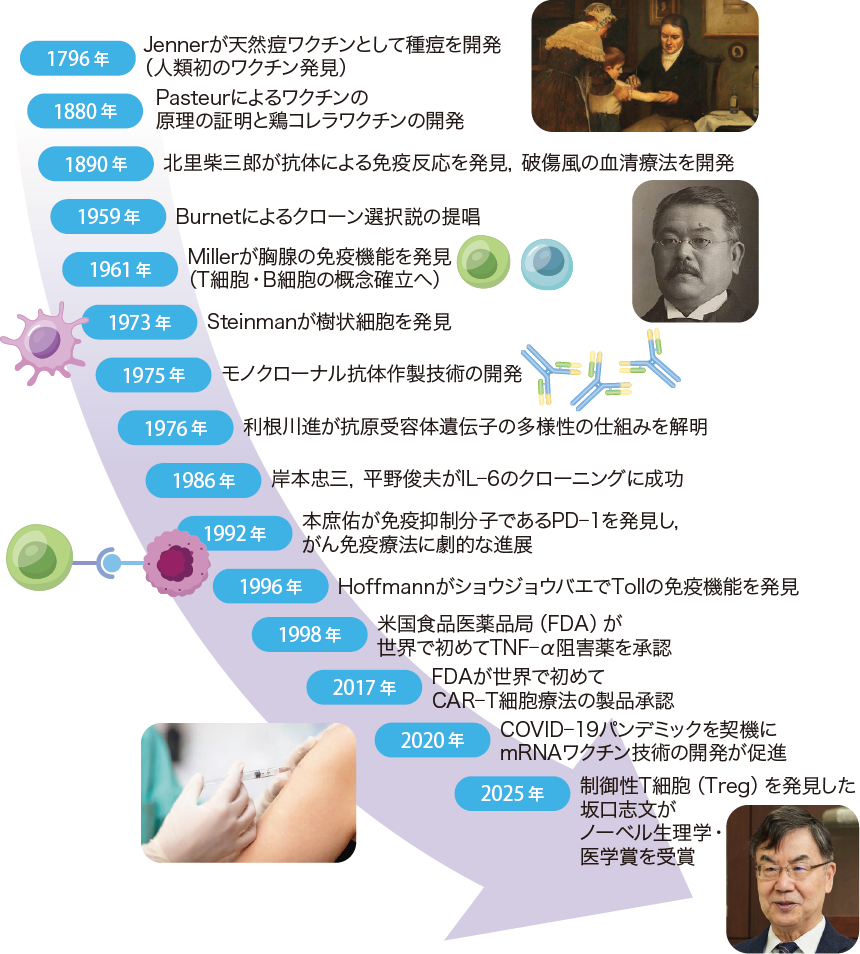
加えて,マウスにおけるprogrammed cell death protein1(PD-1)/programmed death-ligand1(PD-L1)経路の研究から,この経路の阻害が腫瘍免疫応答を活性化し得ることが示され,免疫チェックポイント阻害薬の開発につながるなど,マウス実験にて病態の詳細なメカニズムを解明した上で,ヒト疾患の治療法を開発するという研究手法も確立された。
ヒトとマウスの免疫系の違い
マウスを用いた免疫系の解明が進む一方で,マウスモデルから得られた創薬候補がヒトの臨床試験で失敗する例が相次いで報告された1)。その一因として,ヒトとマウスの免疫系の違いが考えられている。ヒトとマウスの進化系統は約6500万年前に分岐しており,その免疫システムには細胞表現型,遺伝子発現,炎症応答,受容体発現といった複数のレベルで相違が存在する。以下,代表的なものを紹介する。
●末梢血白血球の分画 ヒトは末梢血白血球のうち好中球が50~70%,リンパ球が30~50%と好中球が豊富だが,マウスにおいては好中球が10~25%,リンパ球が75~90%と,リンパ球が優勢である。
●免疫細胞の表面マーカー発現 マウスで同定された細胞がヒトには存在しない,あるいは異なる機能を持つことがある。例えばマウスのB-1b細胞は,T細胞非依存的に,感染に対する迅速かつ抗原特異的な液性応答を担っている一方,ヒトにおけるT細胞非依存性抗体応答は辺縁帯B細胞やIgM陽性/CD27陽性メモリーB細胞が主に担っており,マウスのB-1b細胞に相当する細胞は存在しない。
●遺伝子発現制御とエピゲノム構造 マウスとヒトの間で,特に免疫の遺伝子に隣接するシス調節領域(プロモーター,エンハンサー,サイレンサー等)の配列構造が大きく異なることが,遺伝子発現の違いの主因である可能性が示唆されている。外傷・熱傷・エンドトキシン血症を対象に末梢血mRNAマイクロアレイ解析を行った比較研究では,ヒトとマウスの遺伝子発現変動パターンが著しく乖離していた2)。さらにヒトで有意に発現変化を示した約5000個の遺伝子について発現変動を調べたところ,ヒト-マウス間の相関係数は0.0~0.1とランダムレベルであることが明らかになった3)。これらの結果は,マウスモデルをヒト臨床に応用する際には慎重な解釈が不可欠であることを示している。
●パターン認識受容体(pattern rec-ognition receptor:PRR)の発現 TLRの1つであるTLR9は病原体由来DNAを認識する。TLR9はヒトでは主に形質細胞様樹状細胞およびB細胞に発現するのに対し,マウスではそれらの細胞以外に単球や骨髄系樹状細胞にも発現している。そのためマウスTLR9研究の観察結果から,ヒトにおけるTLR9活性化の効果を正確に予測するのは困難である。
●免疫病態形成におけるサイトカインの役割 抗ウイルス作用を持つサイトカインの一種であるI型インターフェロン(IFN)は全身性エリテマトーデス(SLE)の病態に深く関与しており,ヒトではI型IFN受容体サブユニット1を標的とするモノクローナル抗体であるアニフロルマブがSLE治療薬として承認されている。しかしマウスの場合,同じSLEモデルの中でもNZB/WF1マウスではI型IFN阻害によりSLE様病態が改善し,MRL/lprマウスではI型IFNは保護的に作用し,むしろII型IFN(IFN-γ)が病態を悪化させるといった複雑性を呈している。
また免疫系そのものではなく,生物としての体のつくりや外部環境の違いも,免疫系の違いに影響を及ぼす重要な因子である。
●体重 ヒトとマウスの間には体重に顕著な差異が存在する。大型動物では1クローン当たりのB細胞数が体重に比例して増加する一方で,B細胞クローンの多様性やB細胞が体内を循環するのに要する時間の増加は,体重の増加に比して少ない。そのため体重が軽いと個々の細胞の代謝率が高くなり,細胞の増殖速度が上昇する。例えばウイルス感染後のCD8陽性T細胞の増殖速度は,マウスではアカゲザルの約2倍あると報告されている4)。
●生活環境 ヒトの生活環境と異なり,マウスはSPF(specific-pathogen-free)環境で飼育される。よってマウスモデルとヒト免疫介在性疾患の類似性は限定的であり,マウスで得られた知見のヒトへのトランスレーションには,注意を払う必要がある。
ヒト由来検体を用いたマルチオミクス解析技術
マウスモデルに基づく研究の限界が次第に明らかになるとともに,ヒト自身の免疫機構を,ヒト由来の検体を用いて直接的かつ詳細に解析する必要性が強調されるようになった。そうした論調を後押ししたのが,実際の患者サンプルを用いた精密な解析を可能にする技術的進歩である。
細胞の解析技術として代表的なフローサイトメトリーは,多数の蛍光標識抗体を同時に使用することで複数の細胞表面マーカーや細胞内タンパクを一細胞レベルで同時解析できるため,免疫細胞を詳細に分類できる。さらに次世代シーケンシング(Next-Generation Sequencing:NGS)が2000年代後半頃から実用化され,大量のDNAとRNAの配列データを高速かつ安価に取得できるようになった。従来は特定遺伝子のmRNA発現を定量PCRで個別に測定していたが,現在ではRNAシーケンシングやsingle-cell RNAシーケンシングなどのNGS技術を用いて,細胞集団あるいは単一細胞レベルのトランスクリプトームを網羅的に解析することが可能である。近年は組織切片内で遺伝子発現を同定する空間トランスクリプトーム解析や,タンパク発現を同定する空間プロテオーム解析の活用も進み,組織内の細胞配置や相互作用を視覚化できるようになった。
細胞や遺伝子の網羅的なデータが得られるようになるとともに,データ間,あるいはデータと疾患の関連性を解析する技術も発展した。ゲノムワイド関連解析(genome-wide association study:GWAS)により特定の疾患や形質に関連する遺伝的特徴(疾患感受性多型)を同定し,さらにトランスクリプトーム情報を統合して疾患感受性多型の遺伝子発現への影響を評価するeQTL(発現量的形質遺伝子座:ex-pression quantitative trait locus)解析が可能になった。これにより,個人の遺伝的背景と免疫表現型との関連を明らかにすることが可能になってきた。
機能ゲノムデータベースImmuNexUTの構築
代表的な自己免疫疾患の1つである関節リウマチ(RA)のGWASでは,100以上の感受性多型および遺伝子が同定され,病態とT細胞など適応免疫系やサイトカイン経路との関連が示唆された5)。また同じく自己免疫疾患であるSLEのGWASでは,自然免疫系やI型IFN免疫細胞と病態の関連が示唆された6)。しかし,GWASでは疾患と特定の遺伝的特徴,あるいは免疫系との関連性の有無を示すことはできても,それらが疾患の発症や病態とどう関連しているのかを明らかにすることは困難である。解明には疾患感受性多型とゲノム配列に関する膨大なデータの解析が必要であり,世界的に免疫細胞の機能ゲノムデータベースの構築が進んだ。国内では,筆者らが2021年にImmuNexUT(Immune cell gene expression atlas from the University of Tokyo)を構築している(図1参照)。
ImmuNexUTは,日本人免疫介在性疾患337例と健常対照79例の計416例の末梢血から得た,28種類の免疫細胞遺伝子発現データとゲノム多型情報を統合した大規模機能ゲノムデータベースである。ImmuNexUTによって各免疫介在性疾患の遺伝的リスクと免疫細胞の関連を調べることが可能になり,RAの遺伝的リスクと制御性T細胞との関連性や,SLEの遺伝的リスクとB細胞との関連性などが明らかになった7)。
このように,ヒト由来検体を用いたマルチオミクス解析は免疫介在性疾患の理解を深めるとともに,疾患分類や治療戦略の個別化・層別化に向けた重要な基盤を提供することが可能である(図3)。これを踏まえ次の項では,免疫介在性疾患に関するいくつかの領域に焦点を当て,研究・臨床における近年の進歩を概観する(皮膚疾患領域,呼吸器疾患領域については「個別化医療の実現に挑む」を参照)。
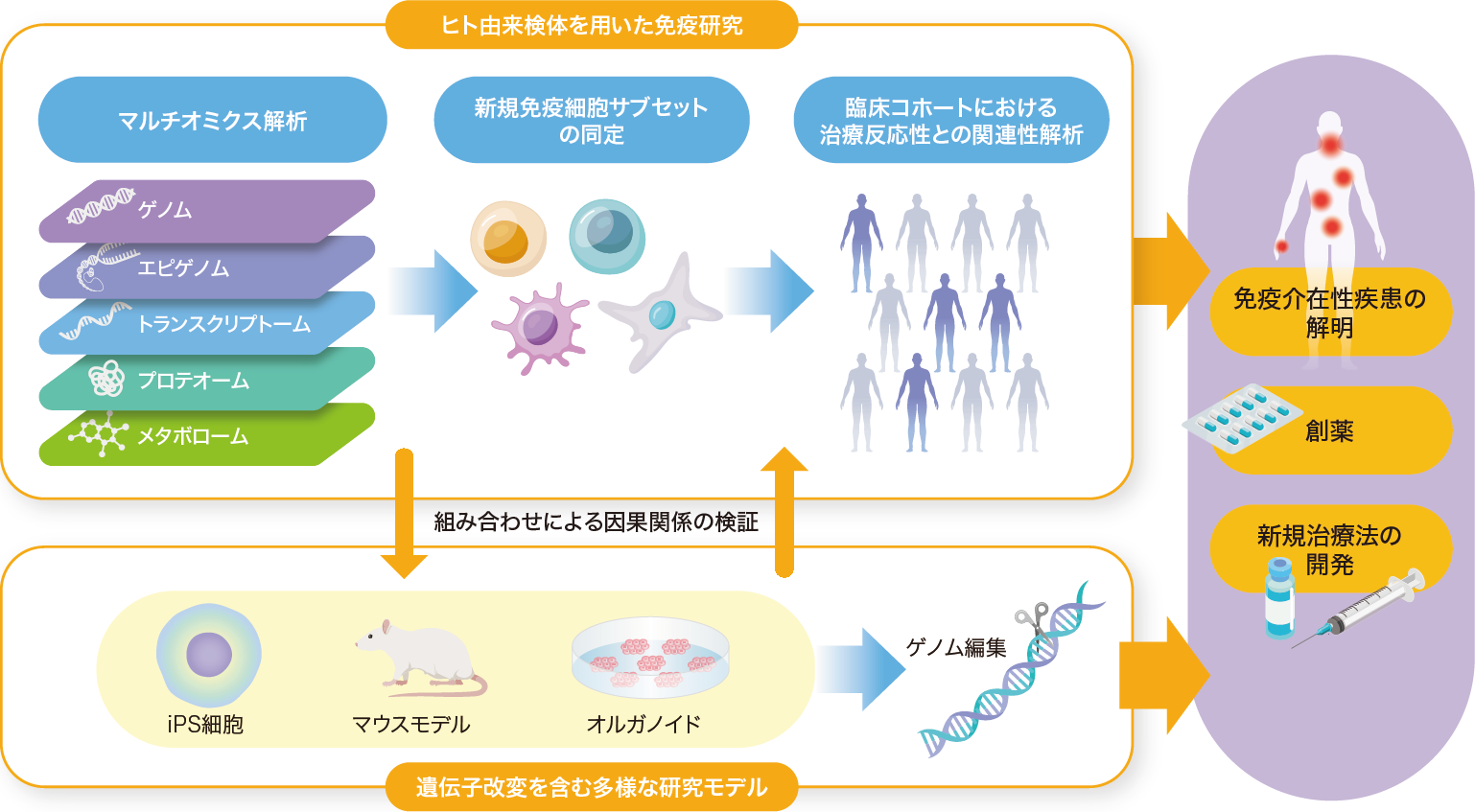
マルチオミクス解析技術の発展により,ヒトの複雑で多様な生体情報をひも解くことが可能になってきている。得られた生体情報や疾患との相関性を他の研究モデルに応用し,そこで得られた情報を還元してさらに詳細な解析を進める循環の繰り返しが,免疫介在性疾患の解明・治療法の開発につながっていく。
臨床応用における近年の進歩
自己免疫疾患
1990年代以降,TNF-α阻害薬やIL-6阻害薬に代表される分子標的薬の開発が進み,自己免疫疾患の治療は飛躍的に進展した。自己免疫疾患のメカニズムは未解明な部分が多く,層別化治療の確立はいまだ課題であるが,マルチオミクス解析の貢献もあり,主要な疾患の病態理解が大きく進歩している。
RAではリンパ臓器の外でB細胞の機能をヘルプするperipheral helper T(TPH)細胞が同定された8)ほか,炎症と関連するMerTK陰性マクロファージが同定された9)。さらにマルチオミクス解析で得られる免疫パラメータと治療反応性との関連についての研究も進んでおり,最近では滑膜の遺伝子発現によってTNF-α阻害薬,IL-6阻害薬,抗CD-20モノクローナル抗体製剤の反応性を予測し,治療薬を選択するアルゴリズムが提案されている10)。またSLEでは免疫細胞におけるミトコンドリア経路の亢進が臓器障害の蓄積と関連することが判明した11)ほか,マルチオミクス解析により同定されたT細胞サブセットの活性化がSLEの病勢と強く関連することが示され12),これらの細胞に対する新規治療戦略の可能性が示唆されている。
がん
21世紀に入り,CTLA-4やPD-1/PD-L1を標的とする免疫チェックポイント阻害薬やCAR-T細胞療法の実用化が進んだ。これら免疫療法は手術・化学療法・放射線療法に続く「第4の治療法」として確立し,従来治療で奏効が得られにくかった進行がんにも新たな希望をもたらしている。一方で,免疫療法の効果には患者間で大きな差異が存在し,一部では無効例や免疫関連有害事象,再発も報告されている。そのため,治療反応性を予測するバイオマーカーの確立と,個別化免疫治療戦略の構築が重要な課題となっている。
近年は,ゲノム・エピゲノム・トランスクリプトーム・プロテオーム・腸内細菌叢などを統合したマルチオミクス解析により,腫瘍免疫応答や免疫抑制的腫瘍微小環境(tumor microenvironment:TME)の分子基盤の理解も進む。その成果として,腫瘍抗原提示経路の破綻やT細胞疲弊の機構解明が進み,個々の病態に応じた層別化モデルの構築や新規治療標的の同定が加速している。個別化がんワクチン(mRNAワクチンを含む)やTCR遺伝子改変T細胞療法,腫瘍浸潤リンパ球(TIL)療法などの開発推進と並行し,AIによる免疫プロファイリング解析や空間多層オミクス技術の導入も進んでおり,腫瘍免疫学は新たな段階に入りつつある。
感染症
COVID-19パンデミックにおいて,mRNAワクチン技術が初めて大規模に実用化された。従来は開発に10年以上を要したワクチンが1年足らずで実現し,ワクチン開発史における画期的な転換点となった。近年はマルチオミクス解析やウイルス抗原の高精度構造解析(例:クライオ電子顕微鏡解析)の技術発展により,感染症に対する免疫応答ネットワークの全体像が明らかになりつつある。その知見を基盤として,ワクチン抗原の構造最適化設計や新規抗ウイルス治療標的の同定が加速している。実際に,ウイルス表面スパイクタンパク質の立体構造情報に基づく抗原デザインは,COVID-19 mRNAワクチンの高い免疫原性と有効性に大きく寄与した。
現在,広範なウイルスに対して作用するユニバーサルワクチンや,mRNAプラットフォームを応用したRSウイルス・インフルエンザワクチンの開発が国内外で進展している。今後は免疫記憶の持続期間を延長するブースター戦略,新興変異株に迅速対応できるmRNA改良技術,そして全世界的な公平供給とアクセス格差の是正が重要な課題である。これらの課題解決に向け,AIを用いた抗原設計や免疫応答予測,mRNA製造の自動化など,新たな技術融合による感染症対策の高度化が期待されている。
ヒト免疫研究のさらなる発展をめざして
今後のヒト免疫疾患研究を発展させる鍵は,ヒトのマルチオミクス解析にあると言える。しかし,同解析で得られる情報の多くは,因果関係ではなく相関関係であるという制約を伴う。そこで同定された免疫パラメータの検証において,遺伝子改変マウスを中心とするモデルマウス,iPS細胞,オルガノイドなどを組み合わせることは,非常に有用であると考えられる。ヒト免疫の解明を促進していくことで,疾患の層別化や新たな治療法の開発,正確な予後予測の実現など,さらなる医療の進歩が期待される。
参考文献
1)J Clin Invest. 2025[PMID:40519165]
2)J Exp Med. 2011[PMID:22110166]
3)Proc Natl Acad Sci USA. 2013[PMID:23401516]
4)Front Microbiol. 2015[PMID:25954270]
5)Nat Genet. 2022[PMID:36333501]
6)Nat Genet. 2015[PMID:26502338]
7)Cell. 2021[PMID:33930287]
8)Nature. 2017[PMID:28150777]
9)Nat Med. 2020[PMID:32601335]
10)Nat Commun. 2025[PMID:40603860]
11)Ann Rheum Dis. 2022[PMID:35236659]
12)Sci Immunol. 2024[PMID:38330141]

藤尾 圭志(ふじお・けいし)氏 東京大学大学院医学系研究科内科学専攻アレルギー・リウマチ学 教授
1995年東大医学部卒。2001年日本学術振興会特別研究員。02年東大大学院医学系研究科内科学専攻博士課程修了。06年東大病院アレルギー・リウマチ内科助教,17年より同科科長および現職。臨床に従事する傍ら自己免疫疾患を中心としたヒト免疫の研究に尽力し,21年には東大病院アレルギー・リウマチ内科の患者データを基に構築した世界最大規模の機能ゲノムデータベース「ImmuNexUT(Immune cell gene expression atlas from the University of Tokyo)」の構築に携わる。
いま話題の記事
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
医学界新聞プラス
[第10回]外科の基本術式を押さえよう――腹腔鏡下胆嚢摘出術(ラパコレ)編
外科研修のトリセツ連載 2025.03.24
-
寄稿 2024.10.08
-
医学界新聞プラス
[第15回]患者さんの氏名をIDに置き換えて「匿名化」すれば,自由に使っても大丈夫ですよね?
研究者・医療者としてのマナーを身につけよう 知的財産Q&A連載 2026.02.17
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。