新年号特集 免疫の謎を解き明かす
ノーベル生理学・医学賞 受賞記念インタビュー
制御性T細胞が問いかける,自己と非自己の境界線
対談・座談会 坂口 志文,藤尾 圭志
2026.01.13 医学界新聞:第3581号より
1995年に制御性T細胞(Treg,図1)を発見し,「自己免疫寛容」の実態解明に多大な貢献をした坂口志文氏が,2025年のノーベル生理学・医学賞を受賞した。「免疫のブレーキ役」として知られるTregの存在に,坂口氏はどのようにしてたどり着いたのか。そして,免疫寛容の解明の先にどのような臨床応用を見据えているのか。本特集号の監修を務める藤尾氏が話を聞いた。
藤尾 このたびはノーベル生理学・医学賞のご受賞,誠におめでとうございます。私が所属する日本リウマチ学会や日本臨床免疫学会においても,今回のニュースは自分のことのように喜びの声が上がっており,「われわれもさらに研究を加速させよう」と大変な熱気に包まれています。ここ10年以上,受賞者の事前予想で坂口先生のお名前が挙がっていましたが,ついに受賞の日を迎えられました。今の率直なお気持ちはいかがでしょうか。
坂口 ありがとうございます。毎年「今年は受賞できるんじゃないか」と言ってくださる方は確かにいました。しかし医学の世界は広大です。毎年1つのテーマの,さらに一部の研究者だけが選ばれるので,これまで声がかからなかったことも全く不思議ではありませんでした。ですから今回の受賞は光栄ですし,同時に非常に幸運でもあったと思います。
藤尾 私が大学院で研究を始めた1990年代後半,先生が95年に発表されたTregの発見に関する論文1)を読んで,「こんな細胞があるのか」と大変興奮したことを覚えています。本日は,免疫学はもちろん医療全体にとっても重要な発見であるTregの研究について,先生が歩んでこられた道程から今後の展望までを伺えればと思います。
「自己を壊す謎」への関心から免疫研究の道に
藤尾 まずは,免疫研究の道に進まれた経緯を教えていただけますか。
坂口 きっかけは医学部在籍時の講義です。当時は分子生物学が発展途上であり,免疫学の分野では抗体の構造こそわかっていたものの,それ以上の詳細なメカニズムは闇の中でした。正直に申し上げれば,講義の内容自体もそれほど面白いものではなかったです。しかし学んでいくうちに,「自己免疫による疾患の発症」という現象に興味を持つようになりました。免疫とは本来,外敵から自分を守るためのシステムです。それがなぜ,自分自身を攻撃し,破壊してしまうのか。例えば,怪我をして出血した時に血液が凝固するのは正常な反応ですが,同じことが血管内で起これば脳梗塞や心筋梗塞といった致死的な疾患につながります。分子レベルのメカニズムは同じはずなのに,反応が起こる場所やタイミングが悪いと病気になってしまう。「自分を守ってくれるべきものが自分を壊す」という矛盾にも近い現象とその背後にあるメカニズムを知りたいと考えたのが,私の研究の原点です。
藤尾 先生が研究を始められた当時は自己免疫疾患の原因も定かではなく,研究手法も限られていた時代ですね。
坂口 ええ。実験系においては,NZB/NZW F1マウスのような自然発症モデルを観察するか,EAE(実験的自己免疫性脳脊髄炎)のように外部から抗原を加えて無理やり炎症を起こすか,その2択しかありませんでした。けれどもそれらのモデルを研究したとして,果たして免疫の本質に迫れるのだろうかとの疑問が常にあったのです。ヒトの疾患と似た現象を記述するデータが得られても,根本的なメカニズムが見えてこないもどかしさがありました。
1960年代初頭には,Millerらによって胸腺が免疫の重要臓器であることがすでに示されており2),その後ほどなくして日本でも免疫系と胸腺の関係に着目した研究が進められていました。私は胸腺の除去と自己免疫疾患発症の関係性を確かめるべく,医学部卒業後は愛知県がんセンター研究所で実験を開始しました。そこで,一度胸腺を切除し,時間を置いて元に戻したマウスでは臓器が破壊されてしまうことを確認したのです。自己抗体の数値が多少上昇したり,リンパ球が浸潤したりといったレベルの変化ではなく,臓器そのものが壊れる完全な「自己免疫疾患」が発症することは大きな驚きでした。つまり,生体には自己攻撃を防ぐ細胞が存在し,それを胸腺除去によって失うことで病気を発症する。これが,免疫系にブレーキ役が存在すると確信した瞬間でした。
進化の中で保存されてきた「免疫寛容」のメカニズム
藤尾 サプレッサーT細胞(註)に代表されるように,当時は免疫抑制機能を持つブレーキ役の細胞の概念が提唱されていたものの,なかなか明確な実態がつかめなかった時期かと思います。その中で先生は,CD25やFoxp3といった確固たる分子マーカーを同定し,Tregという概念を確立されました1, 3)。ブレーキ役の細胞の存在を一貫して追究できた理由は何だったとお考えですか。
坂口 サプレッサーT細胞は概念自体が複雑なこともあり,研究者たちはその存在を決定づけることがとうとうできませんでした。一方で私は,胸腺を除去すると自己免疫疾患が発症する,すなわち「特定の細胞の有無によって疾患が発症するかどうか決まる」という,生体内で起こるシンプルな現象だけを唯一の基準として研究を進めました。サプレッサーT細胞の仮説が誤りだったことで免疫抑制的な細胞の存在そのものが疑問視されてはいましたが,そうした逆風に動じず,自分の手元で確実に証明された現象を信じて一つひとつ積み重ねていこうと思えたことが大きかったのかもしれません。
藤尾 Tregの大きな特徴には,マウスとヒトとの共通性が高く,病態理解や治療法開発に応用しやすい点があると思います。マウスで得られた知見がヒトには当てはまらないケースも多い中で,なぜTregはこれほど種を超えた共通性を有しているのでしょうか。
坂口 私たちの研究は大きく言えば「自己免疫寛容(immunological self-tolerance)」をテーマにしていると言えます。免疫は「非自己」,いわゆる病原体や異物を認識して攻撃する一方で,通常は自分自身の細胞や組織を攻撃することはありません。おそらくこのメカニズムが生物の進化的に強く保存されていることが,Tregの共通性につながっていると考えます。例えば甲状腺炎,1型糖尿病,アジソン病といった自己免疫疾患はしばしば合併しますが,こうした病態の重複はヒトだけでなくマウスやニワトリ,犬などの動物でも見られます。種を超えて同じような病気が起こり,同じようなスペクトラムを呈する事実は,その背後にある共通のメカニズムが進化的にずっと続いていることを示唆しているのだと考えます。
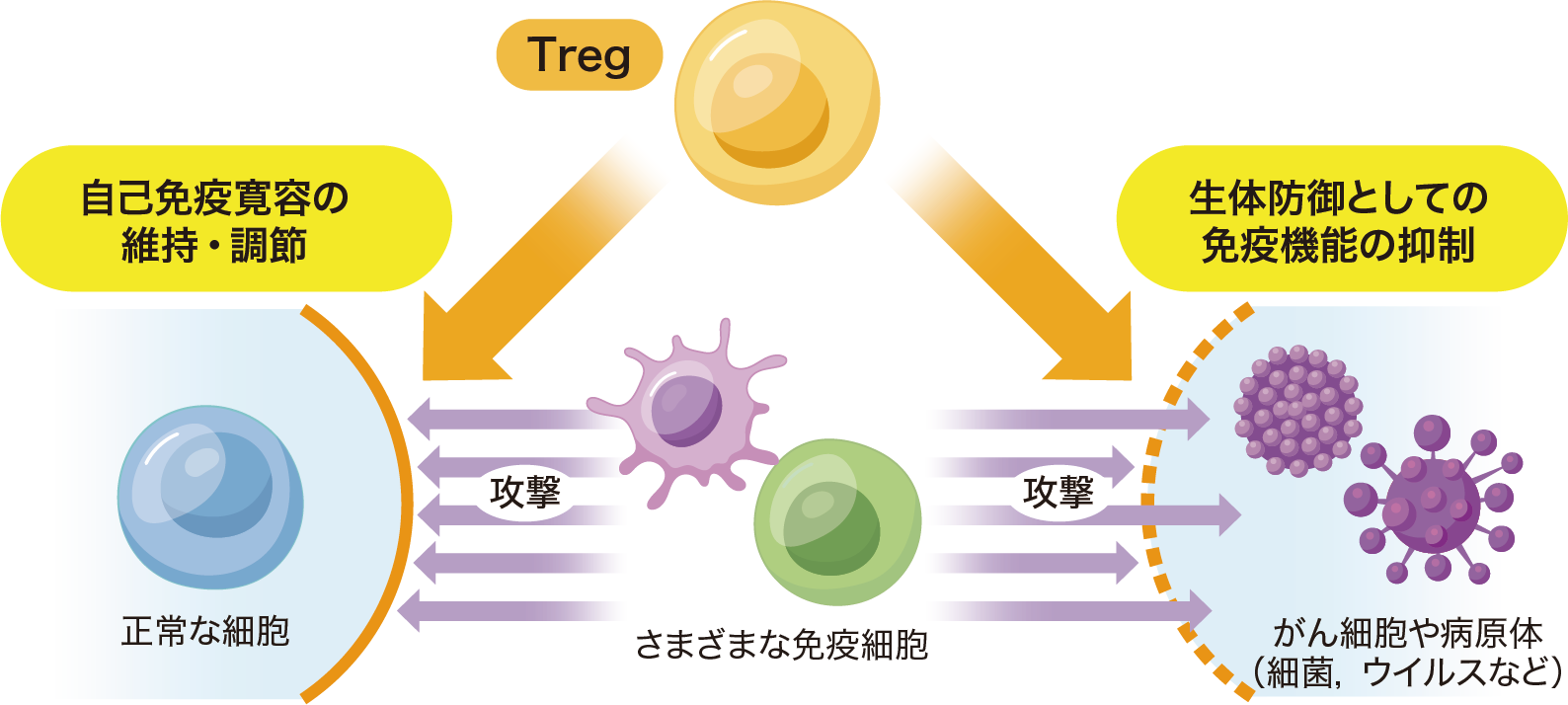
Tregは免疫細胞が自身の細胞や組織を攻撃することを防いで自己免疫寛容を維持しており,その破綻は自己免疫疾患を引き起こす。また,Tregは生体防御としての免疫機能の抑制にもかかわり,過剰な抑制はがんや病原体の増殖を,抑制の不足は過度の免疫反応による炎症を引き起こす。
Tregの研究が見据える治療法の開発
藤尾 私が専門とする関節リウマチや全身性エリテマトーデス(SLE)などの患者さんも,Tregを調べると何らかの機能異常が見られます。これらの自己免疫疾患をはじめ多くの領域でTregを応用した治療法開発への期待が高まっていると思いますが,どの程度進んでいるのでしょうか。
坂口 シンプルなTregの応用法として,疾患の進行時に過剰に反応している免疫細胞の抑制を狙った細胞療法が考えられます。これには患者からTregを採取して増加させる,あるいは患者の体内でTregを増加させるという2通りがあります。例えば,低用量IL-2療法はCD25を高発現するTregを選択的に増加させる試みとして知られていますが,これには課題もあります。非特異的にTreg全体を増加させても,その中に疾患の原因となっている抗原に反応するTregがどれだけ含まれているかわからないのです。また,投与を止めれば効果が切れてしまう問題もあります。
抗原特異的なTregを増加させるのはなかなか難しいことがわかってきたので,最近は発想を変え,病気を起こしている抗原特異的なリンパ球をTregに転換し,かつその機能をできるだけナチュラルなTregに近づけて安定化させるアプローチに注力しています(図2)4)。
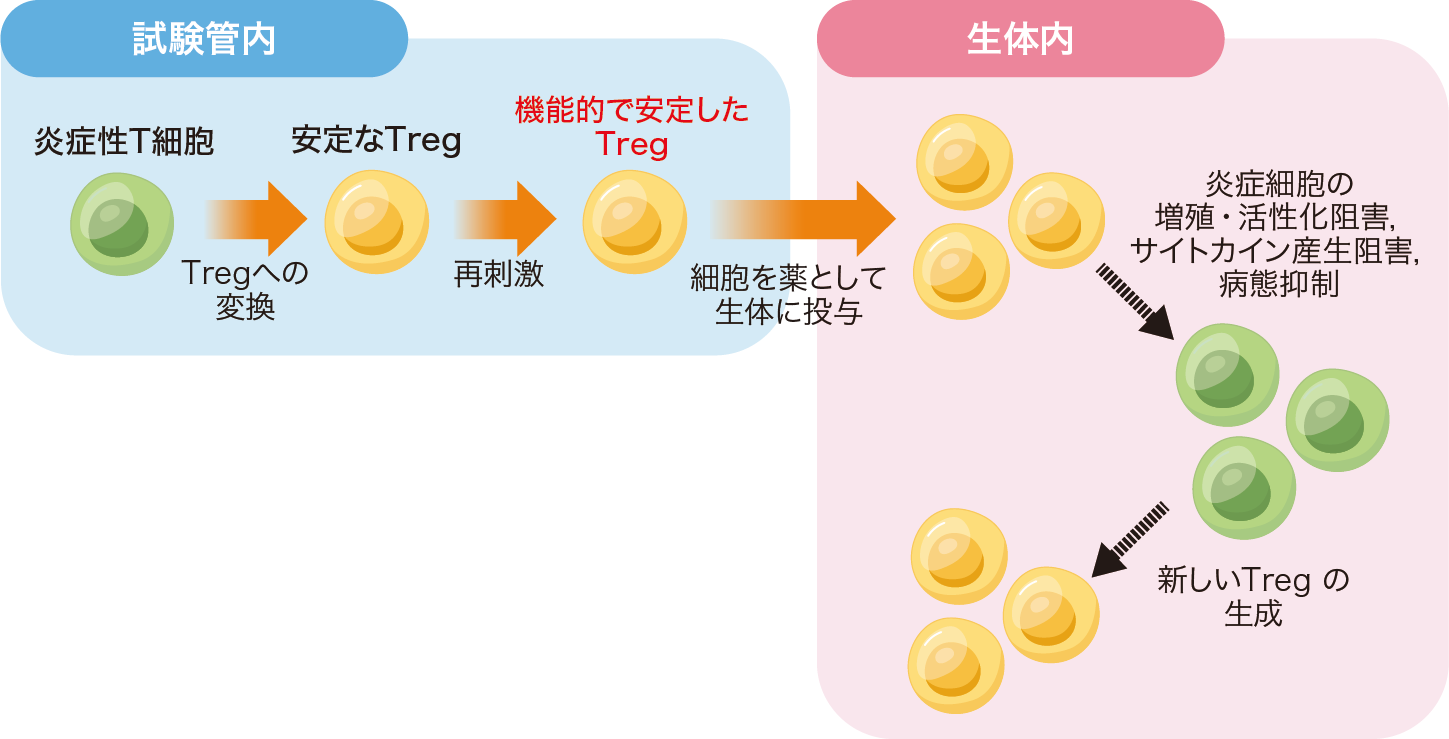
従来は生体にもともとあったTregを採取して体外で増殖させる手法が広く用いられていた。これとは別に,現在は疾患の原因となる炎症性のT細胞を原料とし,人工的にTregを誘導する手法の研究が進む。培養方法の改良もあり,より機能的で安定したTregの誘導が可能になってきている。
藤尾 病気を引き起こしている「悪者」の細胞を利用するということですね。
坂口 その通りです。T細胞が悪さをしているなら,それを遺伝子操作して機能を安定化させた上で強力な抑制機能を持つTregへ転換すればいい。この方法の最大の利点は,もともと病気の原因となっていた細胞を出発点にするため,必然的にその疾患の原因抗原に対する特異性を持っていることです。1型糖尿病やSLEのように複数の抗原が関与する場合でも,患部に集まるT細胞集団をTregに転換して患者に戻せば,その中には確実に抗原特異的な細胞が含まれています。転換された細胞は生体内で抗原に出合うと,Tregとして機能しつつ増殖し,持続的な免疫抑制効果を発揮するはずです。まだ理論段階ですが,有力な治療戦略として今後も開発に注力していきたいと考えています。
次代を担う研究者たちへ
藤尾 自分が追究したいと思える対象に出合い,それを研究・解析し,具体的な治療や病態解明に生かすべく臨床へトランスレーションしていくことは,physician scientistの夢だと思います。今後,日本の若い研究者が先生のような業績を上げていくために,あるいは日本の研究を推進していくために必要なことは何だと考えますか。
坂口 臨床と研究の両面に注力されている方々には,臨床現場から生まれる疑問やヒントを大切にしてほしいです。病気が身近なものであり,現在の治療の限界を理解していることは研究する上でも強みになります。どちらかに軸足を置き続けるのもいいですが,「ベッドサイドからベンチへ,そしてまたベッドサイドへ」という循環を大切にしてほしいですね。また,研究で成果を積み上げていくには論文を書く技術はもちろんのこと,医師・研究者として必要な技術を洗練しつつ,独りよがりの研鑽ではなく他者との切磋琢磨を大切にしなくてはなりません。「やりたい」だけでなく「技術を身につける努力」をする。そういう基本的な姿勢があれば,よい結果につながっていくと思います。
そして何より,研究においては「ロングショットの目標」を掲げてほしいです。例えば移植医療では急性拒絶反応はコントロールできるようになりましたが,慢性拒絶反応はまだ難しいです。究極的には,他人の臓器を免疫系が攻撃せずに,あたかも自分のものとして安全に生着する「完全な免疫寛容」をめざすべきでしょう。自己免疫疾患も同様で,「完全な治癒」をめざすならば,基本的なメカニズムの理解と,それをいかに応用するかという視点が必要です。ある程度射程の長い目標を持ち,現実の病気をいかに理想的な形で治して患者さんに研究を還元していくか。サイエンスやテクノロジーは進歩していくので,その時代の技術を積極的に使ってチャレンジしてほしいです。
藤尾 素晴らしいメッセージをありがとうございます。改めて,ご受賞おめでとうございました。
(了)
註:1970年代,免疫学の世界では「免疫反応を抑える細胞」としてサプレッサーT細胞の存在が提唱されており,多くの研究者が注目していた。しかし遺伝子解析技術の発展とともに実態がないことが徐々に判明し,1980年代には誤りであるとの認識が一般的になった。実際に免疫抑制機能を持ち,坂口氏が発見した制御性T細胞とは,分子生物学的に全く別の概念である。
参考文献
1)J Immunol. 1995[PMID:7636184]
2)Lancet. 1961[PMID:14474038]
3)Science. 2003[PMID:12522256]
4)Sci Transl Med. 2025[PMID:41124284]

藤尾 圭志氏=聞き手 東京大学大学院医学系研究科内科学専攻アレルギー・リウマチ学 教授
1995年東大医学部卒。2001年日本学術振興会特別研究員。02年東大大学院医学系研究科内科学専攻博士課程修了。06年東大病院アレルギー・リウマチ内科助教,17年より同科科長および現職。臨床に従事する傍ら自己免疫疾患を中心としたヒト免疫の研究に尽力し,21年には東大病院アレルギー・リウマチ内科の患者データを基に構築した世界最大規模の機能ゲノムデータベース「ImmuNexUT(Immune cell gene expression atlas from the University of Tokyo)」の構築に携わる。
いま話題の記事
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
医学界新聞プラス
[第10回]外科の基本術式を押さえよう――腹腔鏡下胆嚢摘出術(ラパコレ)編
外科研修のトリセツ連載 2025.03.24
-
寄稿 2024.10.08
-
医学界新聞プラス
[第15回]患者さんの氏名をIDに置き換えて「匿名化」すれば,自由に使っても大丈夫ですよね?
研究者・医療者としてのマナーを身につけよう 知的財産Q&A連載 2026.02.17
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。