新年号特集 老化を治療する
健康で長く生きるためのストラテジー
対談・座談会 中西真,南野徹,柳沢正史,山田泰広
2023.01.02 週刊医学界新聞(通常号):第3499号より

慢性炎症と老化の関連性
中西 日本人の平均寿命は男女ともに80歳を超え,日本は世界の中でも有数の長寿大国と呼ばれています。一方で課題は,日常生活が制限されることなく生活できる期間を指す「健康寿命」の問題です。健康寿命と平均寿命の差は年々縮小しているものの,いまだに男性では8.73年,女性では12.07年存在するとされ(図1)3),老化研究の推進によってその差のさらなる短縮がめざされています。
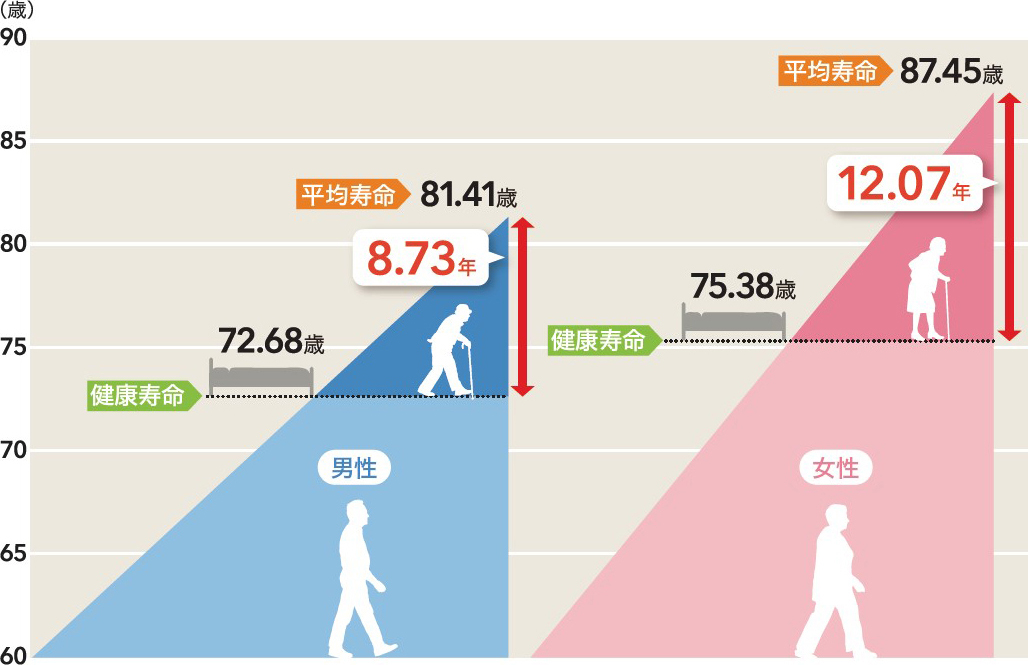
健康寿命と平均寿命の差は,男性では8.73年,女性では12.07年存在するとされ,老化研究の推進によってその差のさらなる短縮がめざされている。
では,そもそもなぜ老化は起こるのでしょうか。循環器内科医として老化制御研究に長年携わる南野先生からお話を伺えますか。
南野 生物が生存していくためには,さまざまな影響で損傷したDNAを修復する必要があります。この際リソースの都合上,生殖細胞系列の細胞が優先的に修復されますが,修復に手が回らなくなった体細胞系列の細胞が体内に蓄積していくことで老化が大きく進展すると考えられています。ヒトにとって老化は避けがたい生理学的現象とも言えるでしょう。
中西 その一方で,老化の表現が見えにくい生物も存在します。例えばカメです。Science誌に掲載された論文によれば,飼育下の52種のカメを解析したところ,大半の種において老化の速度が極めて遅いか,老化の程度が無視できるほど小さいことが示されました4)。また,マウスと同程度の大きさながら最大寿命が30年以上というハダカデバネズミ(以下,デバ,関連記事参照)も特殊な生物です。
これらの生物は,DNA損傷に対してとりわけ強い活性を持っているわけではないとみられています。デバに関する老化研究の論文の共著者にも名を連ねている山田先生は,デバの特殊性をどうとらえていますか。
山田 DNA損傷を修復できなかった細胞を自身の内因性の機能によって排除できる点で,一般的な哺乳類と大きく異なる印象を抱いています。私はもともと病理医ですので,研究の際に病理組織を確認させてもらったところ,炎症細胞の浸潤が非常に少ないことに驚きました(図2)5)。
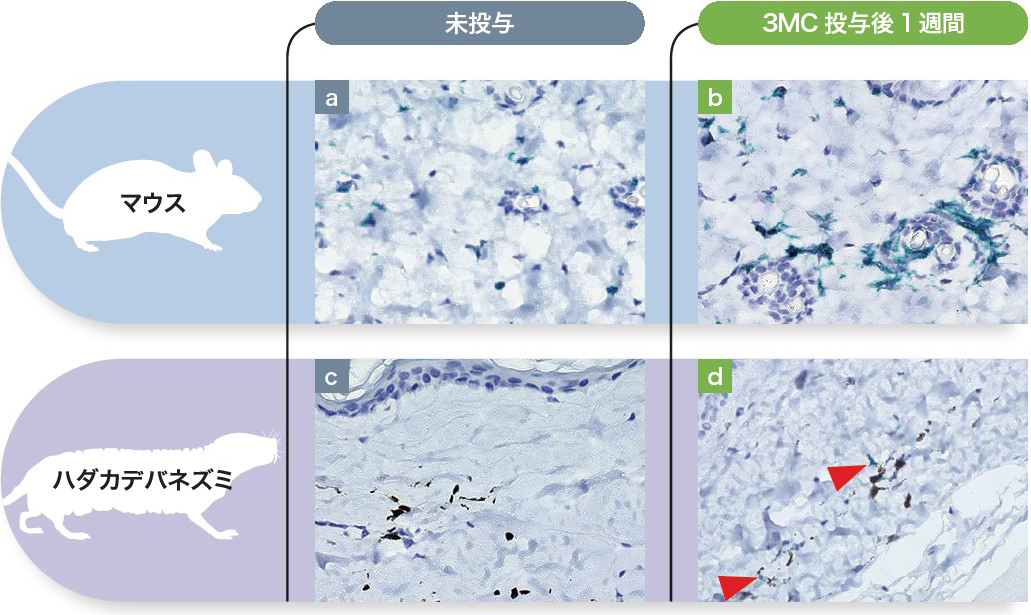
マウス(a)とハダカデバネズミ(c)に3MC(3-methylcholanthrene)による化学発がん誘導を実施した。1週間後に免疫染色(CD45)を行うと,マウスでは陽性細胞が顕著に増加していた(b)のに対し,ハダカデバネズミでは陽性細胞(赤矢印)の増加はわずかだった(d)。
南野 DNA損傷自体が起こっていないということでしょうか。
山田 決してそうではないようです。発がん性のある化学物質に曝露させると,DNA損傷応答は起こっているにもかかわらず,組織切片上では炎症応答が抑制されている印象を強く受けました。
柳沢 炎症が起こること自体は何らかの問題に対する反応・適応をしているとも言えるはずです。理由としては何が考えられますか。
中西 炎症を誘発する細胞へと変化した段階で,すぐに死滅するようにプログラムされているのでしょう。ゾウも同様の仕組みを有していると言われています。
他方,ヒトの炎症誘発細胞はなかなか死滅しにくく,加齢とともに徐々に蓄積し,慢性炎症を引き起こします。最近ではSASP(senescence-associated secretory phenotype,「新たなフェーズに入った老化研究」図4参照)の発見によって細胞に炎症を誘発する仕組みに大きな注目が集まっていますが,私はSASPだけが炎症を誘発する原因ではないと考えています。恐らく数多くの細胞が炎症を誘発し,そうした炎症の総和として全身の臓器組織に広範な炎症を引き起こしているのだろうと。山田先生の見解を聞かせてもらえませんか。
山田 一病理医として,どの細胞が炎症を引き起こす原因なのかには常に興味を持って研究を続けてきました。AMED-CRESTで採択された課題「時空間老化制御マウスを用いた細胞老化が及ぼす個体生命機能の理解」は,この答えを明らかにしようとスタートさせたのですが,いまだに明らかにできていません。ただ,私も中西先生と同様,本当に細胞老化が誘導された老化細胞だけが老化に影響を及ぼしているのかについては疑問を抱いています。
中西 少数の老化細胞が,果たして「個体の老化」という非常に大きな変化をもたらせるのか……。大きな変化ではないものの,より広範に炎症を誘発する仕組みがあった上で,老化細胞が個体の老化を後押ししているのかもしれませんね。
ほとんど全ての生物に現れる睡眠の神秘
中西 そうすると,私含め,柳沢先生,南野先生も携わるムーンショット研究「目標7 2040年までに,主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムを実現」〔プログラムディレクター・平野俊夫氏(量子科学技術研究開発機構)〕で着目している「炎症」は,やはり老化研究の重要なキーワードと言えそうです(図3)。
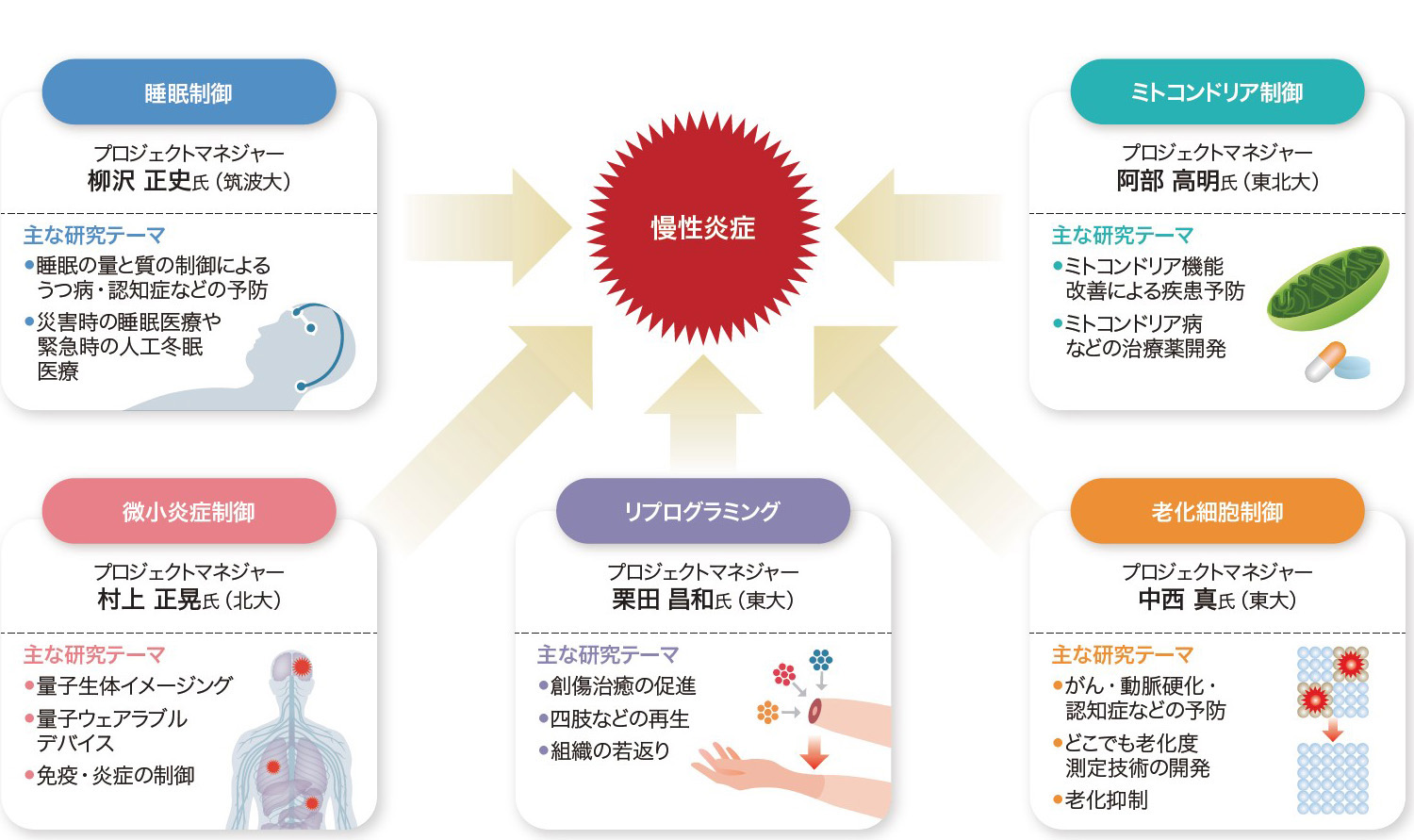
慢性炎症は老年病発症の根本にあることから,健康寿命の延伸の実現をテーマに掲げ,さまざまな角度から慢性炎症の制御をめざす。
私は分裂能が限られる細胞,例えば神経細胞の場合,DNA損傷の影響をあまり受けず,炎症の発生も少ないのではとの印象を持っています。睡眠研究の第一人者である柳沢先生から,睡眠と炎症の関係性について教えてもらえますか。
柳沢 論文数はまだ少ないものの,睡眠とDNA損傷との関係が注目されています。例えば,神経細胞では覚醒中にDNA損傷が蓄積し,それが睡眠中に修復されている可能性を示唆した論文です6)。また,眠らせない状態を続ける断眠を長時間行うと,脳内のマクロファージであるミクログリアが活性化します。恐らくアストロサイトも活性化していると考えられ,断眠によって脳は一種の炎症状態に陥ってしまうと言えます7)。
中西 種にかかわらず全ての生物は睡眠をとるのでしょうか。
柳沢 どこまでを睡眠と定義するかにもよりますが,神経系を持つ全ての動物に睡眠が現れます8)。はっきりと申し上げられるのは,進化の過程では脳が誕生するよりも先に睡眠が誕生していることです(図4)9)。例えばヒドラも眠るし,クラゲも眠ります。彼らは神経系を有し,プランクトンを捕食しますが,脳は持っていない。しかし,明らかに睡眠しているのです。一定以上の複雑な神経系を有すると,睡眠が必要になるのでしょう。
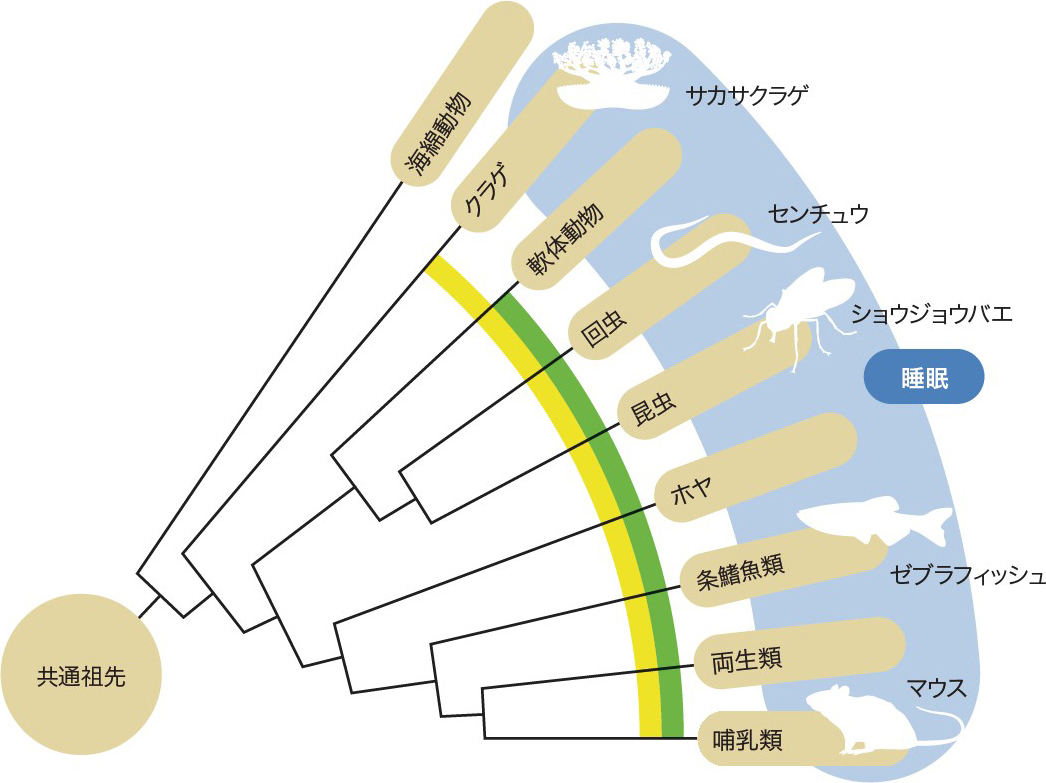
黄色部分は神経細胞の存在が確認されている生物,緑色部分は中枢神経系(脳)の出現を認めた生物。進化の過程では脳が誕生するよりも先に睡眠が誕生している。
中西 つまり,睡眠は強く制御されたメカニズムだということですね。
柳沢 どうも分子レベルで相当に保存されているようです。眠気を表現していると思われる細胞内の経路をマウスで発見しました10,11)。同じ経路が,複数の種でも認められています。
南野 睡眠と寿命の間に関連性はあるのでしょうか。
柳沢 はい。実はヒトを対象とした研究が最も進んでいて,睡眠と死亡リスクに相関関係があることが知られています。単純な睡眠量だと,成人の場合,7時間前後寝ている人が最も死亡リスクが低く,短すぎても長すぎてもリスクは高まります12)。睡眠時間が短い場合は睡眠不足によって死亡リスクが上昇する一方,十分に睡眠が足りていれば必要以上には眠れないので,9時間,10時間と毎日寝ている方は,それだけの身体的原因があるということで,やはり死亡率が高まっていきます。
最近注目されているのは,睡眠の質の問題です。睡眠には,大脳皮質が広範に同期活動する状態であるノンレム睡眠と,急速眼球運動と骨格筋活動の消失を特徴とするレム睡眠がありますが,全睡眠時間に占めるレム睡眠の割合が少ない人ほど平均余命が短いとされています13)。
南野 先ほど話題に挙がったDNA損傷の修復が,レム睡眠の間になされている可能性はあるのでしょうか。
柳沢 可能性の1つではありますが,まだはっきりしていません。ただレム睡眠中は,ノンレム睡眠中や覚醒中と比較して,大脳皮質の血流量が急激に上昇することがわかっています14)。またレム睡眠の時間は,個体差はあるものの年齢とともに減っていく傾向にあります15)。この結果も,脳の老化との関連があるのかもしれません。
山田 睡眠の質の劣化が全身の臓器の老化を促進しているとすれば,どのようなメカニズムが考えられますか。
柳沢 非常に興味深い質問ですが,お答えできるほどの知見が揃っていないのが現状です。単純な話をすると,例えばラットに断眠をさせると2週間ほどで死を迎えます。しかし「なぜ死ぬのか」と問われると,同時多発的にさまざまな問題が発生していますので,何がプライマリ・イベントかがわかりません。誰も答えられないのです。
中西 今の山田先生の仮説はとても面白いと感じました。老化の速度には個体差があるものの,一個体でみると特定の領域だけ老化が進んでいるというケースは少ない。だからこそ,個体の中に老化の速度を決めるような機構が存在し,制御している可能性が考えられるのです。
柳沢 個々の細胞に刻まれた特性なのか,中枢のようなものが全てを制御しているのか,はたまたそのどちらもが制御に関連しているのか,非常に興味がありますね。
冬眠研究のヒトへの応用にかかる期待
中西 話題は変わりますが,冬眠は通常の睡眠とは異なるのでしょうか。
柳沢 ええ。睡眠が昼と夜,つまり自転に対する動物の適応だとすれば,冬眠は夏と冬,すなわち公転への適応と表現でき,食物が得られない冬の期間をどう生き延びるかを目的に進化した結果です。われわれの仲間の櫻井武先生(筑波大)が最近,冬眠様の状態をマウスで創り出すことに成功して注目を浴びました。
冬眠の深さは種によって差がありますが,冬眠する生物は極端に基礎代謝を下げることと低温耐性を共通の性質として備えています。例えばリスの場合は,体温5℃になっても臓器に全く障害が起こりません。ただ,クマなどの冬眠中の脳波を見ると,どうも寝たり起きたりしているようです。
中西 冬眠から覚醒する時は,何かのシグナルがあるのでしょうか。
柳沢 こちらもメカニズムはよくわかっていません。しかしながら覚醒はかなり規則的ですので,高度に制御された機構であることは間違いないでしょう。
中西 そうすると,概日リズムである24時間周期以外の,睡眠リズムとも呼ぶべき別の周期が存在するのかもしれませんね。そのファクターが老化とも関係していそうです。
柳沢 冬眠と睡眠の話題を話した時によく質問を受けるのは,「冬眠中は老化の時計が止まるのか」という点です。もしも難治性の病いにかかってしまった時に,治療法が開発されるまで人工的に冬眠させることができれば,ある意味不老不死のようになりますよね。これは究極の老化研究とも言えます。
中西 実現の見込みはあるのですか。
柳沢 櫻井先生が発見した休眠誘導神経(quiescence-inducing neurons:Qニューロン)を刺激すると,マウスの体温・代謝が数日間にわたって著しく低下することが明らかになっています16)。Qニューロンはヒトにも存在しますので,うまく刺激できる技術があれば原理的には可能と言えるでしょう。ヒトへの応用にはさまざまなハードルが立ちはだかりますが,実現できれば世界を大きく変えるはずです。
Senolyticsは人類の希望となり得るのか
柳沢 睡眠の領域で研究成果が次々と発表されているのと同様に,老化研究も近年盛り上がりを見せていますね。何がブレークスルーとなったのでしょうか。
中西 「遺伝学的な手法で老化細胞を除去する(senolytics)と,種々の加齢性疾患が予防でき,がんの発症率も低下する」との趣旨が記された論文が,2011年に米Mayo clinicから報告されたことがきっかけです17)。
ヒトの場合,ほとんどの疾患の原因が老化と言っても過言ではなく,今後は老化そのものを克服していく研究が必要になると私は考えています。すなわち老化を「病い」としてとらえていく必要性です。南野先生はどのようにお考えですか。
南野 Extension codeではありますが,ICD-11で“aging-related”というタグが追加されました。そういう意味では,病気に与える影響として老化が注目されている背景でもあるのでしょう。すでにいくつかの薬剤で,senolyticsとしての有効性が確認されています(表)18)。

柳沢 臨床応用はどの程度進んでいるのでしょう。
南野 現状,日本ではsenolyticsをヒトへの介入研究に用いることは認められていません。他方米国では,フレイルや慢性腎臓病患者に対する臨床研究が進んでいます。ただし,いずれも「対象疾患にsenolyticsを投与した時に何らかのサロゲートマーカーが改善するか」という程度の臨床研究です。
中西 その通りですね。Senolyticsを目的に投与された薬剤が,「本当に個体の中で老化細胞を除去できているのか」「老化細胞除去の影響がどの程度あるのか」までを明らかにできるような研究デザインではありません。マウスレベルではsenolyticsによる老化の改善は認められており,効果が期待できることは確かですが,ベースになる基礎研究が進展する前に「臨床だ!」と周囲が湧き立ってしまっているのが現状ではないかと見ています。老化の克服は人類の長年の夢であり,研究資金も豊富に投入されています。けれども研究の質は是正されるべきだと考えます。
南野 否定的な研究結果が続いてしまうと手法自体が怪しいものととらえられかねず,研究デザインや対象疾患は念入りに選ぶべきです。ブラインドで2群間の比較をするのは難しいために,希少疾患で治療法の見つからない患者群に介入をすれば,senolyticsの効果を測れるのかもしれません。端的に言えば,がんの臨床研究と同じ手法を選択するということです。生存期間の延長が認められれば,結果的に肯定的な結論を導けます。
中西 まずは希少疾患で検証をしていくのがよいのでしょうね。米国で着目されているのは特発性肺線維症です。患者数が少なく,比較的治験が組みやすいとの話を聞いています。
また近年は,疾患をターゲットにするのではなく,有効な治療法がなく,かつ加齢に影響を受けやすい線維化(fibrosis)に注目が集まっています。
柳沢 ヒトに投与した場合では,マウスとは異なり,より複雑に効果が発現してしまう可能性があるため慎重な検討が必要ですよね。ヒトとマウスで個体寿命が大きく異なることも念頭に置かなければなりません。
南野 ええ。DNA修復の機構や細胞周期の制御機構も大きく異なります。やはりヒトのほうがかなり緻密に制御されている印象であり,臨床応用にはきちんとしたステップを踏んでいく必要があるでしょう。
山中因子を用いて細胞の若返りをめざす
中西 最近では,ノーベル賞受賞者の山中伸弥先生(京大)が発見した,細胞の初期化を誘導する4つの遺伝子(Oct4,Sox2,Klf4,cMyc,通称:山中因子)を用いて細胞の若返りをめざす,リプログラミング研究が行われています。山田先生はその分野における日本の第一人者です。リプログラミングによって老化の克服が実現する可能性はあるのでしょうか。
山田 究極的には可能性のある技術だと思っています。2013年,若山照彦先生(山梨大)が25世代のクローンマウスを作り続けた中で,核移植を繰り返しても初期化異常が蓄積しないこと,そして各世代の発生能が低下しなかったことを報告しました19)。これはつまり,世代ごとにゲノムの異常が起こる可能性を孕むにせよ,少なくともリプログラミングによってエピゲノム制御状態をリセット可能であることを示唆しているのだと考えられます。
南野 現在では世界各地で山中因子を用いた研究が行われていますよね。
山田 ええ。特に2021年に米国で設立されたAltos Labsの動きは顕著です。22年には30億ドル規模の資金調達を果たし,リプログラミング研究を加速させています。
南野 リプログラミングされた細胞は,元の細胞のように分裂能を持つのでしょうか。
山田 ベストセラーにもなった『LIFESPAN――老いなき世界』(東洋経済新報社)の著者である,米ハーバード大のSinclair氏による視神経の軸索再生の研究では,「細胞分裂は起こっておらず,増殖なしに軸索の再生が認められる」と報告されています20)。リプログラミングにおいては細胞分裂に伴うDNAの複製が重要であるとの考え方がありましたが,セルサイクルに入る必要がない,すなわち細胞分裂が必要ない可能性もあるのかもしれません。
柳沢 軸索が伸びたことで視機能は改善したのですか。
山田 そのようです。しかし再現論文がまだ出ていないのも事実。発表から2年程度が経過しているために,今後慎重に検討していく必要もあると考えます。
柳沢 心筋細胞に対するリプログラミング研究の進展はどうなのでしょう。
南野 心筋細胞は幹細胞の存在自体が否定的とされており,リプログラミングして幹細胞様の心筋細胞を増加させることは難しいとの見立てがなされています。一方,一過性の山中因子の導入は,部分的には心筋細胞の増殖を誘導し,心筋梗塞後の心機能を改善するとの報告もあります21)。一般的には臨床応用を考慮して,アデノ随伴ウイルス(adeno-associated virus:AAV)などのベクターを用いて,心機能を改善し得るような遺伝子を体内に導入していく手法の検討が進んでいます。
中西 ただしAAVベクターは,導入可能な遺伝子の長さが決まっている上,遺伝子発現させるプロモーターも限られていることから,個体の中の標的細胞に効果が出ているのかを把握しづらいのは難点でしょう。
南野 そうですね。AAVベクターの中には心筋細胞特異的に発現させるように設計されたものもありますが,新規の手法として面白いのはナノ粒子を用いた遺伝子導入でしょう。安全性も高く,実現可能性も高いように考えています。今後の研究の進展に期待ですね。
一歩一歩成果を積み重ね,研究を前に進める
中西 それでは最後に,今後の研究の抱負を一言ずついただければと思います。
柳沢 私の専門とする睡眠研究と同様に,老化研究もまだ緒に就いたばかりとの印象を受けました。まずは焦らず,きちんと基礎のメカニズムを追究するところから,一歩一歩成果を積み重ね,進んでいくのが大事だと考えます。
南野 同感です。例えば治療薬として導入したいのであれば,「どこに効いているのか」という基礎的な部分を明らかにした上で社会実装へ至らなければ,「恐らく効果を発揮するだろう」との段階でヒトに応用されてしまう可能性がある。このようなことが起こらないようにしていきたいですね。けれどもマウスに固執しすぎていると見えない景色があることも真実です。ヒトでの作用点を明らかにするようなストラテジーを,研究と並行して見いだしていくことも重要だと考えています。
山田 地に足のついた研究,かつヒトへの還元を強く意識した基礎研究を着実に進めていく必要があると思う一方で,知的好奇心に導かれた研究も重要だと考えています。私たちが得意とする遺伝子改変動物作製技術を積極的に活用することで,老化にかかわるヒト病理組織形態の変化を分子で説明できるような研究を展開したいですね。ワクワクするようなエキサイティングな研究で,結果的に社会に還元できる医科学研究を行うことが目標です。
中西 ありがとうございます。ヒトの最大寿命は120歳程度とされていますが,老化研究の延長線上に,最大寿命の延伸は起こり得ないと現時点では考えています。一方で,いったい何がヒトの生物学的な最大寿命を決めているのか。この点は,非常に興味があるところです。できるだけ長く健康で生きることを実現させるための研究を私も続けていきたいと思います。結局,それが人類にとっての幸福に近付く一番の近道のはずですから。
(了)
参考文献・URL
1)総務省.「統計でみるあの時といま No.3」第1回国勢調査時(大正9年)といま.2014.
2)厚労省.百歳の高齢者へのお祝い状及び記念品の贈呈について.2022.
3)橋本修二.健康寿命の算定・評価と延伸可能性の予測に関する研究――2019年の算定,2010~2019年の評価,2020~2040年の予測.2021.
4)Science. 2022[PMID:35737795]
5)Commun Biol. 2022[PMID:35354912]
6)Nat Commun. 2019[PMID:30837464]
7)Nat Med. 2017[PMID:29106402]
8)McNamara P, et al(eds). Evolution of Sleep. Cambridge University Press. 2009.
9)Curr Biol. 2017[PMID:28943083]
10)Nature.2022[PMID:36477539]
11)Nature.2022[PMID:36477534]
12)Sleep. 2004[PMID:14998237]
13)JAMA Neurol. 2020[PMID:32628261]
14)Cell Rep. 2021[PMID:34407410]
15)Science. 1966[PMID:17779492]
16)Nature. 2020[PMID:32528181]
17)Nature. 2011[PMID:22048312]
18)須田将吉,南野徹.循環器疾患と細胞老化.実験医学.Vol.40 No.3 pp384-9,2022..
19)Cell Stem Cell. 2013[PMID:23472871]
20)Nature. 2020[PMID:33268865]
21)Science. 2021[PMID:34554778]

中西 真(なかにし・まこと)氏 東京大学医科学研究所副所長・癌防御シグナル分野 教授
1985年名市大医学部卒。89年同大大学院医学研究科博士課程修了。自治医大医学部生化学講座講師,国立長寿医療研究センター老年病研究部室長,名市大大学院医学研究科基礎医科学講座細胞生化学分野教授などを経て,2016年より現職。21年GLS1阻害薬が老化細胞を選択的に除去し,組織の加齢現象や老年病,生活習慣病を改善させることをScience誌に報告する。ムーンショット型研究開発事業「老化細胞を除去して健康寿命を延伸する」のプロジェクトマネジャー。

南野 徹(みなみの・とおる)氏 順天堂大学大学院 医学研究科循環器内科 教授
1989年千葉大医学部卒。東大医学部第三内科にて「エンドセリンと動脈硬化」についての研究で学位を取得。テロメア・テロメラーゼに関心を持ち,97年米ハーバード大にリサーチフェローとして留学し,血管老化研究に取り組む。2001年に帰国後,千葉大大学院医学研究院循環病態医科学講師,新潟大大学院医歯学総合研究科循環器内科教授などを経て,20年より現職。現在は循環器内科診療と老化制御研究に注力する。日本抗加齢医学会副理事長。

柳沢 正史(やなぎさわ・まさし)氏 筑波大学 国際統合睡眠医科学研究機構 機構長
1985年筑波大医学専門学群卒。88年同大大学院基礎医学系博士課程修了。大学院在学中の87年に血管収縮因子エンドセリンを発見した。同大講師,京大講師を経て,91年に渡米。米テキサス大サウスウェスタンメディカルセンター准教授兼ハワードヒューズ医学研究所准研究員,96年同センター教授兼同研究所研究員。98~99年には睡眠覚醒に関与する神経伝達物質オレキシンを発見する。2010年筑波大教授を兼任。12年より現職。22年には日本人4人目となるブレークスルー賞(生命科学部門)の受賞者に選出される。

山田 泰広(やまだ・やすひろ)氏 東京大学医科学研究所 システム疾患モデル研究センター 先進病態モデル研究分野 教授
1997年岐阜大医学部卒。2002年同大医学系研究科で学位を取得。同年病理専門医。03年には世界で最初にトランスジェニックマウスを作製した,米マサチューセッツ工科大ホワイトヘッド研究所Rudolf Jaenischラボの研究員として在籍。05年に帰国後,岐阜大大学院医学系研究科講師,准教授などを経て,09年京大iPS細胞研究所特定拠点教授,12年同研究所教授。17年より現職。現在はiPS細胞技術を駆使した生体内リプログラミング研究に取り組む。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
対談・座談会 2025.08.12
-
寄稿 2024.10.08
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
対談・座談会 2025.12.09
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。

