新年号特集 老化を治療する
新たなフェーズに入った老化研究
寄稿 城村由和
2023.01.02 週刊医学界新聞(通常号):第3499号より
老化は生物に起こる普遍的な生命現象であり,広辞苑によれば「年をとるにつれて生理機能がおとろえること」や「時間の経過とともに変化し,特有の性質を失うこと」と定義されている。老化のプロセスは非常に複雑で,高分子,細胞,組織・臓器,全身統合システムといった生物のさまざまな階層で,多くの異なる変化が並行して起こっている。このように老化した結果の記述はあるが,なぜ老化が進行するのか,その原因や制御機構についてはほとんど解明されてこなかった。多くの生命科学者が,老化に伴うさまざまな変化を「熱力学第二法則に従い,エントロピーの増大に伴って時間の経過とともに損なわれるプロセス」ととらえ,行き当たりばったりで起こるものだと考えていたために,精力的に研究が行われてこなかったことが,その理由の一つである。
しかし分子遺伝学の急速な発展により,20世紀後半から出芽酵母,センチュウ,ショウジョウバエ,マウスといったモデル生物を用いた老化・寿命に関する研究が大きく進展した。そして現在,老化のプロセスは他の多くの生物学的プロセスと同様に,古典的なシグナル伝達経路,転写因子,さらにはエピジェネティクス因子による制御を受けることが明らかになるとともに,ごく単純な環境および遺伝的介入によって寿命を延ばし,老化時の健康状態を改善できることもわかった。
他方,正常細胞ががん遺伝子活性化や酸化ストレス,DNA損傷などのさまざまな外的・内的要因によるストレスを受けると,一時的な細胞周期停止やアポトーシスに加え,細胞老化が誘導されることが知られている(図1)。細胞老化が誘導された細胞(老化細胞)は,不可逆的な増殖停止や扁平・肥大化,炎症性サイトカイン・ケモカインなどの生理活性因子を分泌する表現型(senescence-associated secretory phenotype:SASP)などの特徴を持つことが明らかになった。興味深いことに,加齢に伴いさまざまな組織・臓器に老化細胞が蓄積することが報告されており,遺伝工学的にマウス生体内の老化細胞を除去すると加齢性疾患の改善や健康寿命の延伸が見られた。これらの報告から,細胞老化は個体老化の主要因の一つであることが示唆され,近年,注目を浴びている。

そこで本稿では,老化の原因や制御機構の解明に大きく貢献してきた,モデル生物を中心とした個体老化研究および細胞老化研究に関するこれまでの歴史的変遷(図2)について紹介するとともに,それらの知見に基づいて検討される老化治療のビジョン(図3)を概説する。

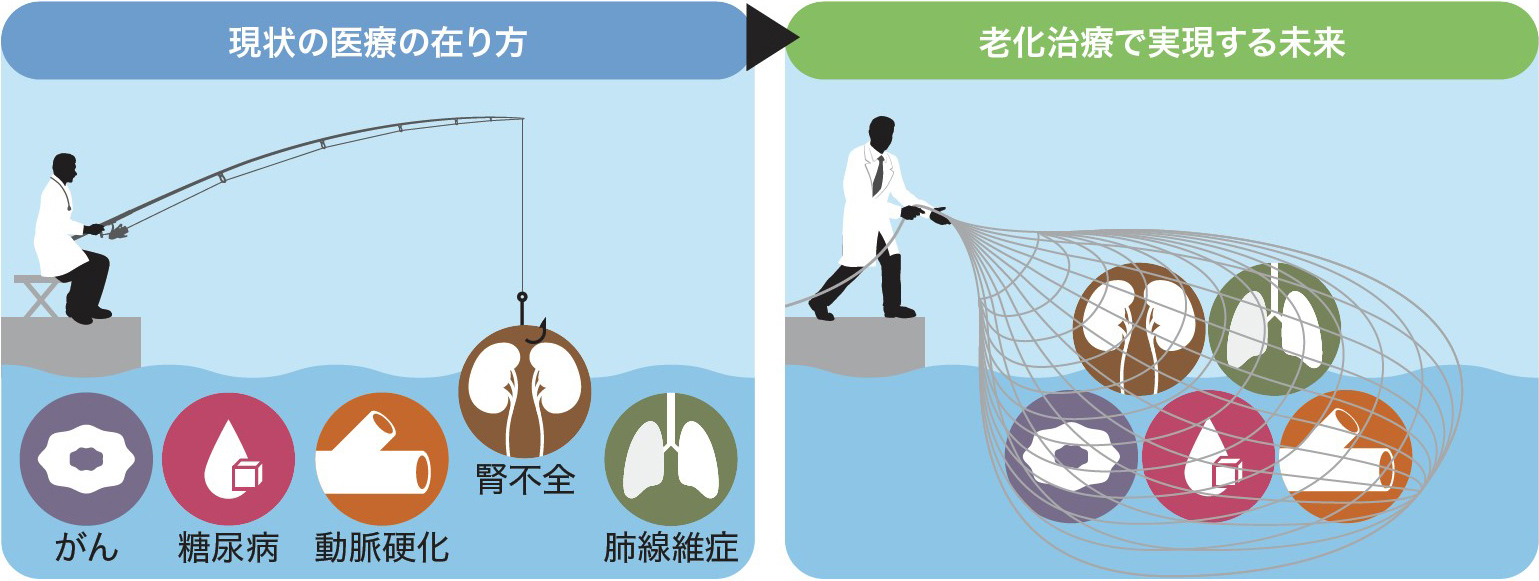
これまでは,個々の加齢性疾患に対して個別の治療法を確立する必要があったが,「老化」を共通の病因と見なすことで,同じ治療で多くの疾患をターゲットにすることができる。
モデル生物を中心とした個体老化研究の変遷
老化の遺伝的根拠を探ろうとした最初の研究はセンチュウで行われた。1977年,Klassは,低温下での生育や食餌の減量といった環境の変化によってセンチュウの寿命が延びることを明らかにした1)。さらに,age-1と名付けられた特定の遺伝子がこのプロセスに関与している可能性が示され,現在最もよく知られている老化の経路であるインスリン/IGF-1シグナル伝達経路(IIS)に関係していることが解明された2)。その後の研究により,インスリン受容体をコードするdaf-2やその下流の標的など,他のIIS構成因子の変異でも寿命が延びることも明らかになった3~6)。中でも,観察された寿命の延長がDAF-16〔FOXO(Forkhead box O)ファミリー転写因子〕の核内移行に不可欠であることをKenyonらが明らかにしたことは特筆すべき点だ3)。DAF-16の過剰発現はそれだけで寿命延長に十分であり,他の長寿関連経路にも共通するエンドポイントであるとされる。その後もIISは,ショウジョウバエやマウスなどの高等生物でも寿命を調節していることが次々と明らかにされた7~9)。
また1995年,米マサチューセッツ州ケンブリッジの研究者グループが出芽酵母の長寿関連遺伝子を見つけ出そうとした際,老化機構の解明につながる突破口を新たに開いた。Kennedyらが,ストレス耐性と長寿の相関関係を利用して,飢餓に強く,寿命が長い変異体を次々と発見したのである10)。そのうちの1株は,SIR(silent information regulator)4に変異を有していた。さらなる解析により,SIR4はSIR2とSIR3とともに複合体を形成することや,SIR2がリボソームDNAのサイレンシング(註1)に重要な酵素活性を有すること,SIR2の過剰発現が寿命延伸に十分であることが示された11)。その後の研究ではSIR2が,新規のNAD+(nicotinamide adenine dinucleotide,註2)依存的なヒストン脱アセチル化反応を触媒することが明らかにされた12)。つまりNAD+のような重要な細胞内代謝分子とSIR2の酵素機能が結びつき,代謝,サイレンシングおよび老化の間に驚くべき関連性があることがわかったのだ。さらに,IISと同様に,SIR2のオルソログ(註3)であるサーチュインファミリーが,センチュウ,ショウジョウバエ,マウスなどの高等生物の老化を制御することが立て続けに示されている13~15)。
加えて,IISやサーチュインファミリーが代謝経路と密接に関与することやNAD+の補充によってマウスの寿命が延びるといった知見から,代謝の変化が老化プロセスの一因である可能性が示唆された。実際,栄養飢餓状態においてATP産生を誘導するAMPKや,IISの下流エフェクターであり細胞の増殖や代謝を調節するmTORなどの栄養感受性経路も老化を制御していることが報告されるようになってきた16, 17)。
細胞老化研究の変遷
1882年,Weismannは,加齢に伴う「消耗した組織」が臓器不全の基礎となること,そして細胞分裂による修復は「有限」であり,消耗が続く中でこの能力が枯渇すると,最終的に臓器不全に至るという仮説(消耗仮説)を提唱。その後1961年にHayflickらが,ヒト初代線維芽細胞を試験管内で連続培養していると,ある回数だけ分裂し,やがて増殖を停止することを見いだした。この現象は「ヘイフリック限界」あるいは「複製老化」と呼ばれ,細胞老化の概念が提唱された18)。腫瘍細胞は不死であり細胞老化の徴候を全く示さないことなどから,細胞老化による増殖能低下が生体の衰えを細胞に反映したものと考えられ,老化のプロセスと関連づけられるようになり,老化の分子機構を解明する方法として細胞老化への移行を制御する因子の探索が行われるようになった。
1987年のGreiderとBlackburnによるテロメラーゼの発見後,Greiderらがヒト線維芽細胞においてテロメア短縮と老化を結びつけた。実際に,ヒト血管においてテロメア短縮は加齢に依存して起こることが示され,ヒト動脈内皮において心血管疾患の危険因子となり,老化に大きな影響を与えることが明らかになった19, 20)。
また,発がん性RASの発現が早期の細胞老化を誘導するとの画期的な発見が,Loweらによってなされた...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。
城村 由和 金沢大学がん進展制御研究所 がん・老化生物学研究分野 教授
いま話題の記事
-
新年号特集 免疫の謎を解き明かす
ノーベル生理学・医学賞 受賞記念インタビュー
制御性T細胞が問いかける,自己と非自己の境界線対談・座談会 2026.01.13
-
2026.01.13
-
新年号特集 免疫の謎を解き明かす
ヒト免疫の解明は医療に何をもたらすのか対談・座談会 2026.01.13
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
医学界新聞プラス
生命の始まりに挑む ――「オスの卵子」が誕生した理由
林 克彦氏に聞くインタビュー 2026.01.16
最新の記事
-
2026.01.13
-
新年号特集 免疫の謎を解き明かす カラー解説
マウスとヒトの知見が交差する免疫学寄稿 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ノーベル生理学・医学賞 受賞記念インタビュー
制御性T細胞が問いかける,自己と非自己の境界線対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ヒト免疫の解明は医療に何をもたらすのか対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
臨床免疫学が迎えるパラダイムシフトインタビュー 2026.01.13
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
