新年号特集 老化を治療する
健康長寿を実現するためのヒントを探す
寄稿 新井康通,三浦恭子,石谷太
2023.01.02 週刊医学界新聞(通常号):第3499号より
人類史上最も長生きをした人物として,122年と164日を生きた,フランスのJeanne Louise Calment氏(1875-1997)がギネス世界記録に登録されている。長寿化が進み,全世界で数十万人と百寿者が珍しくなくなった中でも,この数字は驚異的と言えるだろう。平均的な寿命を大きく超えて生きる生物に特徴はあるのか。抗老化の手がかりを探る研究者たちに寄稿を依頼した。
百寿者研究に見る長寿者の特徴
新井 康通
地球規模で進行する高齢化を背景として,認知症や動脈硬化などの加齢関連疾患が急増し,健康寿命をいかに延伸するかが重要な課題となっている。100歳以上の高齢者(以下,百寿者)の多くは90歳代までADLの自立を維持しており,世界中で健康長寿のメカニズムの解明を目的とした百寿者研究が盛んだ。本稿では,世界の百寿者研究の潮流と,私たち慶應義塾大学の研究チームが取り組む110歳以上の長寿者であるスーパーセンチナリアンを対象とした研究の知見について概説する。
百寿者研究の国際動向
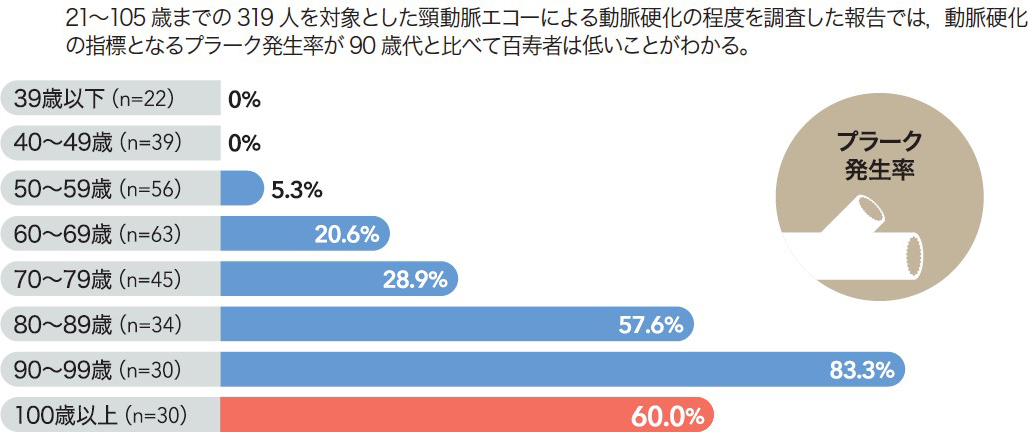
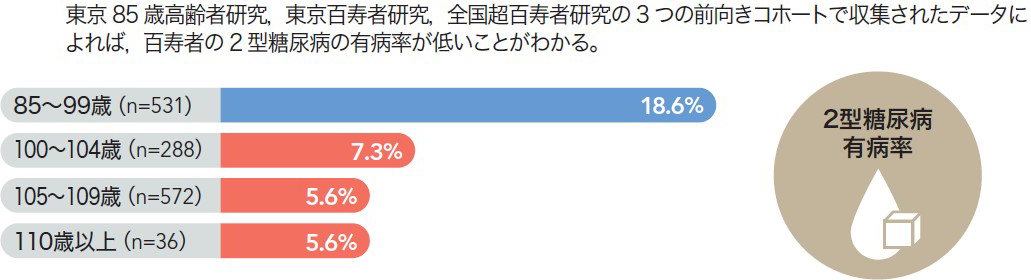
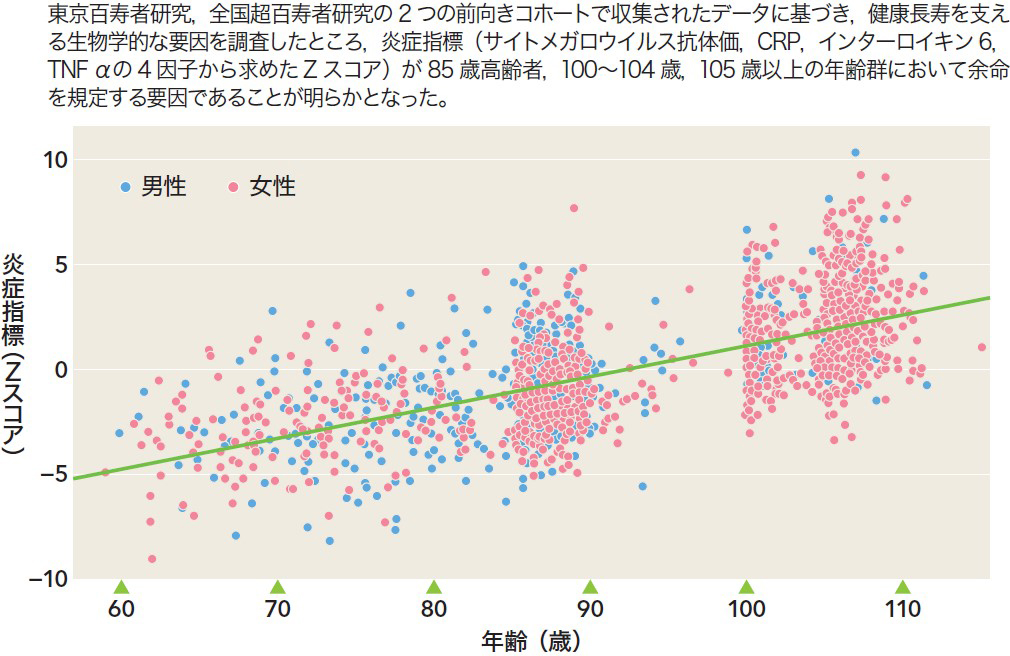
百寿者研究は,1980年代後半からイタリア,米国,日本など人口当たりの百寿者数が多い国で行われてきた。2000年以降は百寿者人口の急増を背景に世界中に広がり,遺伝的背景から生活習慣,心理社会学的特徴まで幅広い分野の研究が展開されている。これまでの研究から百寿者に共通する特徴として,①動脈硬化になりにくい(図1)1),②インスリン感受性が高く,糖尿病の有病率が低い(図2)2),③加齢に伴い炎症反応が亢進する(図3)3)ことが報告されている。各国の研究動向を見ると,イタリアのFranceschiは1980年代から百寿者の免疫学的側面に注目した研究を続けており,加齢に伴い炎症性サイトカインが百寿者の障害や死亡につながることに注目。Inflammagingという概念を提唱した4)。最近では細胞老化と炎症をつなぐSASP(senescence associated secreotome phenotype)が提唱され,inflammagingは老化のメカニズムを担う重要な概念として定着している5)。
米国からは,PerlsやBarzilaiが百寿者とその子孫の遺伝子解析で多くのインパクトのある報告をし6, 7),オーストラリアではSachdevが,百寿者の認知機能と脳の加齢性変化について脳MRIや剖検脳の解析から研究報告を出した8)。またオランダの100 plus studyでは,認知機能が保たれている百寿者に対象を絞って縦断的に観察し,認知機能の推移,亡くなった後の剖検脳の解析から脳老化に対する抵抗性のメカニズムの解明をめざしている9)。
私たちの研究チームは,20年以上に及ぶ東京百寿者研究,全国超百寿者研究を通じ,世界的にも極めてまれなスーパーセンチナリアンの医学生物学的調査を進め,心血管疾患リスクが低い,心腎循環システムの老化が遅いなどの特徴を明らかにしてきた10)。このように各国でさまざまな領域の百寿者研究が行われているが,最近の百寿者研究の潮流として認知機能解析と長寿関連遺伝子の研究に精力が注がれている。
長寿関連遺伝子解析結果を老化制御メカニズムの解明につなげる
ヒトの寿命に遺伝的要因が影響する割合は20~25%程度と報告11)されており,環境因子などの後天的要因の役割が強いと考えられる。しかし長寿関連遺伝子の同定は,老化制御メカニズムの解明や治療介入ターゲットの発見につながることが期待でき,各国で百寿者の遺伝子解析が精力的に行われている。1994年にフランスのSchacterらが,百寿者では若年対照群と比較してAPOE4アリル頻度が低く,APOE2アリル頻度が高いことを初めて報告12)して以来,候補遺伝子アプローチによる長寿関連遺伝子探索が盛んに進められた。2010年以降は,ゲノム全体を対象として百寿者集団と非長寿コントロール集団の遺伝多型のアリル頻度を比較するGWAS(genome-wide association study)が用いられようになったものの,人種を超えて追試確認されているのはAPOEとFOXO3のみである。
GWASによってさまざまな疾患と関連する何千もの遺伝子変異が発見されてきたが,多くの疾患には多遺伝子が関与し,それぞれは遺伝的効果の少ない複数のSNPs(一塩基多型)が累積して疾患リスクを高めていると考えられる。そこで,何千あるいは何百万ものSNPsの情報を統合合算する多遺伝子リスクスコア(polygenic risk score:PRS)が提唱されている。Gunnらは,New England Centenarian Studyと,Long Life Family StudyのGWAS結果から,54の疾患と表現型に対するPRSを計算し,長寿者では冠動脈疾患やアルツハイマー病のPRSが低く,親の長寿に対するPRSが高いことを報告した13)。PRSは人種差を考慮する必要があるため,当研究チームでも日本人百寿者においてさまざまな疾患PRSを検証し,長寿と疾患の遺伝素因の関連を検討している。
マルチオミクス解析と将来展望
各国によるバイオバンクの整備,次世代シーケンスと情報解析技術の格段の進歩は,数十万~百万人単位の集団のGWAS解析を可能とし,数多くの疾患感受性遺伝子や関連する分子経路を解き明かしている。しかし百寿者を対象としたGWASは,その希少性からせいぜい数千人規模であり,この方法で長寿関連遺伝子を同定するには限界がある。そこで,エピゲノム,トランスクリプトーム,プロテオーム,マイクロビオームなどのマルチオミクス解析によって,百寿者の健康長寿のメカニズムに迫る研究に注目が集まる。
イタリアの研究では,105歳以上の82人と彼らの子孫63人の末梢血単核細胞(PBMC)由来DNAのメチル化年齢を測定したところ,彼らとその子孫は一般の高齢者に比較してメチル化年齢が若いことが報告された14)。また当研究チームでは,理化学研究所生命医科学研究センターと共同でスーパーセンチナリアン7人から採取した血液細胞を対象にシングルセルRNA発現解析を行った。すると,通常は少量しか存在しないCD4陽性キラーT細胞がスーパーセンチナリアンに多く存在することが明らかとなり,増殖したCD4陽性キラーT細胞はクローン性増殖が起きていたことも判明した15)。
さらに,健康長寿と腸内細菌叢との関連も注目されている。本田賢也教授(慶大)の研究グループは,百寿者の便中に二次胆汁酸の一種であるイソアロリトコール酸が特異的に多いことを見いだし,その胆汁酸を合成できる腸内細菌株を同定した16)。加えて,イソアロリトコール酸が極めて低濃度でグラム陽性病原性細菌の増殖を抑制することを発見。百寿者の腸内ではイソアロリトコール酸が豊富に存在しているためグラム陽性病原性細菌の排除が促進され,健康な腸内環境を維持できている可能性を示した。
将来的には,こうした百寿者・スーパーセンチナリアン研究の成果を一般の高齢者の健康増進や予防医学の革新へつなげるトランスレーショナル研究を加速させる必要がある。モデル生物を用いた基礎老化研究では,ゲノム不安定性,エピジェネティック異常,老化細胞の蓄積,炎症などのHallmarks of agingが提唱されており17),これらをターゲットとした抗老化介入の研究が盛んになっている。健康長寿のモデルであるスーパーセンチナリアンの脳や心臓などの重要臓器ではHallmarks of agingがどのように制御されているかを明らかにできれば,老年病の予防や治療法の開発に貢献できる可能性がある。今後は,老化モデル動物における実験科学的知見と対照しながら,全ゲノム解析,トランスクリプトーム解析,シングルセル解析などの最先端技術を導入し,健康長寿メカニズムの分子的・遺伝的基盤を解明する研究をめざしていきたい。
参考文献
1)Stroke. 2001[PMID:11283378]
2)Nat Commun. 2020[PMID:32732919]
3)EBioMedicine. 2015[PMID:26629551]
4)Ann N Y Acad Sci. 2000[PMID:10911963]
5)J Geron...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

新井康通(あらい・やすみち)氏 慶應義塾大学医学部百寿総合研究センター長
1991年慶大卒。英ニューカッスル大加齢健康研究所客員研究員,慶大医学部内科学(老年内科)助教,同大百寿総合研究センター専任講師などを経て,2021年より現職。同大看護医療学部教授兼任。

三浦 恭子(みうら・きょうこ)氏 熊本大学大学院生命科学研究部老化・健康長寿学講座 准教授
2010年京大大学院医学研究科博士課程修了。博士(医学)。山中伸弥,岡野栄之両教授に師事。慶大医学部生理学特別研究助教,日本学術振興会特別研究員,科学技術振興機構さきがけ専任研究者を経て,14年北大遺伝子病制御研究所テニュアトラック講師,16年同研究所准教授。17年より現職。

石谷 太(いしたに・とおる)氏 大阪大学微生物病研究所 教授
1998年名大理学部卒。2002年同大大学院理学研究科を修了。博士(理学)。同大でのポスドクを経て,06年九大生体防御医学研究所にて特任助教授として独立。17年群馬大生体調節研究所教授,19年より現職。非哺乳類モデルを使いつつもヒトのバイオロジーに真剣に向き合うことを信条とし,小型魚類の威力・魅力を医療者に紹介することをライフワークとしている。22年より国際ゼブラフィッシュ学会理事。
いま話題の記事
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
-
対談・座談会 2026.02.10
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
