事例で学ぶくすりの落とし穴
[第9回] がん薬物療法における臨床検査値
連載 髙橋 沙季,池田 龍二
2021.03.22 週刊医学界新聞(看護号):第3413号より
「がん薬物療法」としてすぐに思いつく薬剤は何でしょうか。古くから使用されてきた殺細胞性抗がん薬を想像する方が多いと想像します。近年では殺細胞性抗がん薬に加え,がん細胞の持つ特異的な標的分子を利用する分子標的薬も使用されるようになっています。それぞれ実際の事例をもとに対応策を確認していきましょう。
事例1 右眼内悪性リンパ腫に対してR-MPV療法(リツキシマブ+メトトレキサート+プロカルバジン+ビンクリスチン)2コース目を投与予定の52歳男性。投与当日の採血結果を確認したところ,白血球数1900/mm3,好中球14.8%(281.2/mm3),ヘモグロビン10.6 g/dL,血小板数10.6万/mm3であった。好中球減少が起きていることから2コース目の投与が不可であると考え,医師に確認を行い,投与中止となった。その後,顆粒球コロニー形成刺激因子(G-CSF)製剤が投与された。
事例2 舌癌に対してペムブロリズマブ(キイトルーダ®)単独療法投与開始予定であった62歳男性。ペムブロリズマブ投与は初回であるが,他の免疫チェックポイント阻害薬(Immune Checkpoint Inhibitor:ICI)を以前使用していたため内分泌系検査のオーダーがされていた。検査結果はTSH 33.65 μIU/mL,FT4 0.7 ng/dL,FT3 2.84 pg/mLとTSHが高値であり,レボチロキシン(チラーヂン®)の内服が開始となった。
押さえておきたい基礎知識
殺細胞性抗がん薬
殺細胞性抗がん薬の有害事象において共通して問題になるのが「骨髄抑制」です。抗がん薬の多くは細胞分裂の盛んながん細胞を攻撃しますが,同様に正常細胞のうち細胞分裂の盛んな骨髄も抗がん薬の攻撃を受けます。その結果,骨髄抑制が起こり,白血球(好中球),赤血球,および血小板が減少します1)。こうした抗がん薬による薬物有害反応の分類は,世界共通の指標として有害事象共通用語規準(Common Terminology Criteria for Adverse Events:CTCAE)が用いられています(表1)2)。事例1ではGrade 4に該当する好中球数減少が起きており,生命を脅かす,または緊急処置を要する状態に該当します。
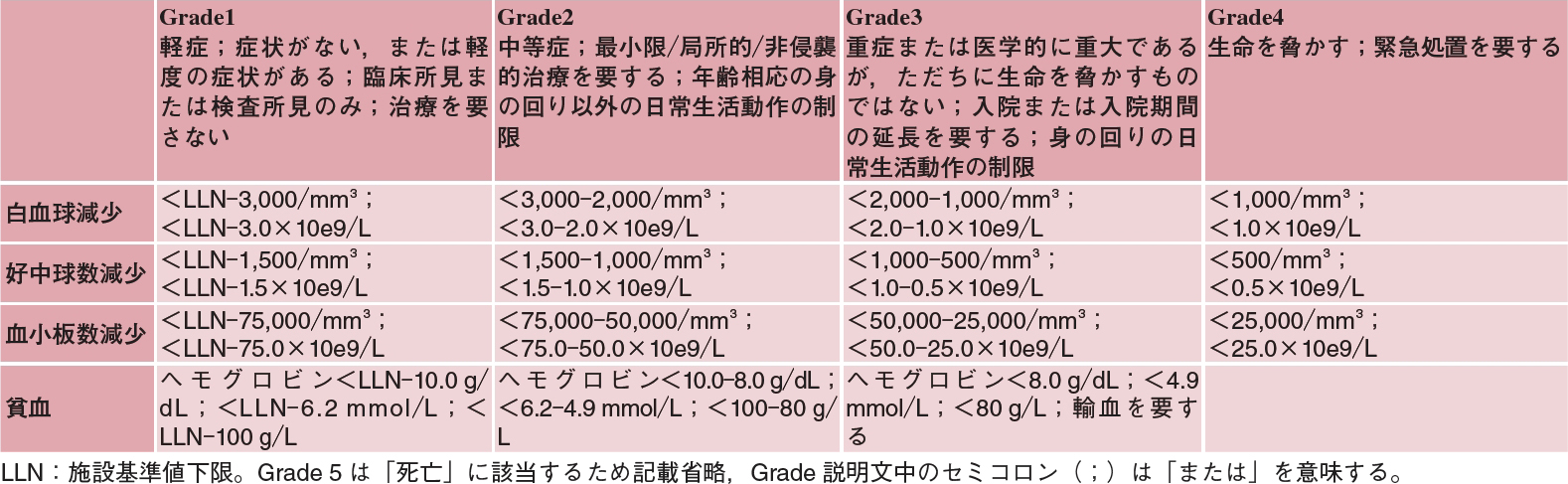
白血球減少を起こす多くの抗がん薬のNadir(最低値)は,投与後7~14日前後に現れます1)。本事例では1コース目の投与は13日前であり,2コース目投与当日がNadirに該当...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
医学界新聞プラス
[第4回]高K血症――疑うサインを知り,迅速に対応しよう!
『内科救急 好手と悪手』より連載 2025.08.22
-
子どもの自殺の動向と対策
日本では1 週間に約10人の小中高生が自殺している寄稿 2025.05.13
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
最新の記事
-
2026.01.13
-
新年号特集 免疫の謎を解き明かす カラー解説
マウスとヒトの知見が交差する免疫学寄稿 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ノーベル生理学・医学賞 受賞記念インタビュー
制御性T細胞が問いかける,自己と非自己の境界線対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ヒト免疫の解明は医療に何をもたらすのか対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
臨床免疫学が迎えるパラダイムシフトインタビュー 2026.01.13
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
