日本発の遺伝子治療を世界へ
トランスレーショナル・リサーチを実現する策とは
インタビュー 藤堂 具紀
2021.05.10 週刊医学界新聞(通常号):第3419号より

「日本は遺伝子治療開発において世界に勝る独自の最先端技術を持っているにもかかわらず,臨床応用という点では欧米に大きな遅れを取っています」。こう指摘したのは,独自に開発した技術を基に,2020年12月に日本で初めてがんのウイルス療法製品の製造販売承認申請を行った藤堂氏。革新的な基盤技術を臨床に応用するトランスレーショナル・リサーチ(以下,TR)を日本で成功に導くためには何が必要なのか。実用化に至るまでをアカデミア主導で行ってきた経緯とともに,日本の遺伝子治療の現在地を聞いた。
――2020年12月28日,悪性神経膠腫を適応症とするがんのウイルス療法製品の製造販売承認申請が行われました。製品開発の基盤となったがん治療用ヘルペスウイルスG47Δ(註)の発明1)から実用化に至るまでの行程を一貫してアカデミア主導で行ってきたことは,日本におけるTRの歴史の中でも注目すべき事例と考えます。
藤堂 1991年のScience誌に,悪性脳腫瘍をウイルスで治療するアイデアを記したMartuza氏の論文2)が発表されてから約30年。G47Δは日本で初めて実用化されるウイルス療法製品であり,国際的にも脳腫瘍に対しては先進国初のウイルス療法薬となります。非臨床試験から治験製品の製造,規制への対応,治験実施まで,製薬企業を介さずにようやく製品化へたどり着きました。本製品は先駆け審査指定品目になっているため,販売承認申請から承認までは6か月がめざされます。今夏までには承認が下りると期待しています。
遺伝子治療の対象疾患はがんが中心に
――藤堂先生が行われてきたウイルス療法は,日本では遺伝子治療に分類されます(図1,2)。そもそも遺伝子治療とはどのような治療を指すのですか。
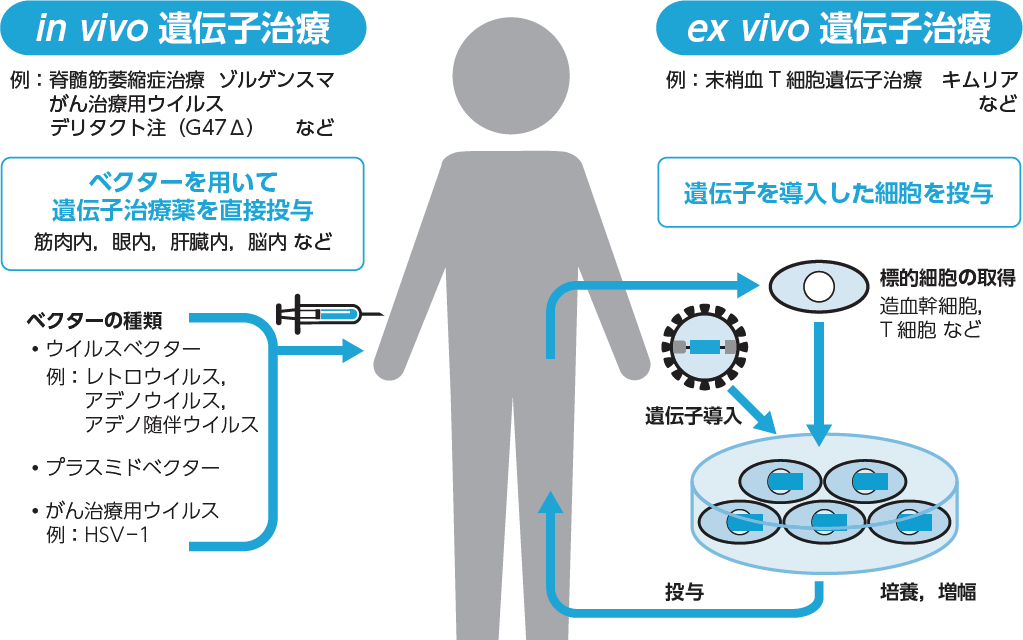
ベクターを用いて遺伝子治療薬を直接投与するin vivo遺伝子治療と,遺伝子導入した細胞を移植するex vivo遺伝子治療に大きく分けられる。
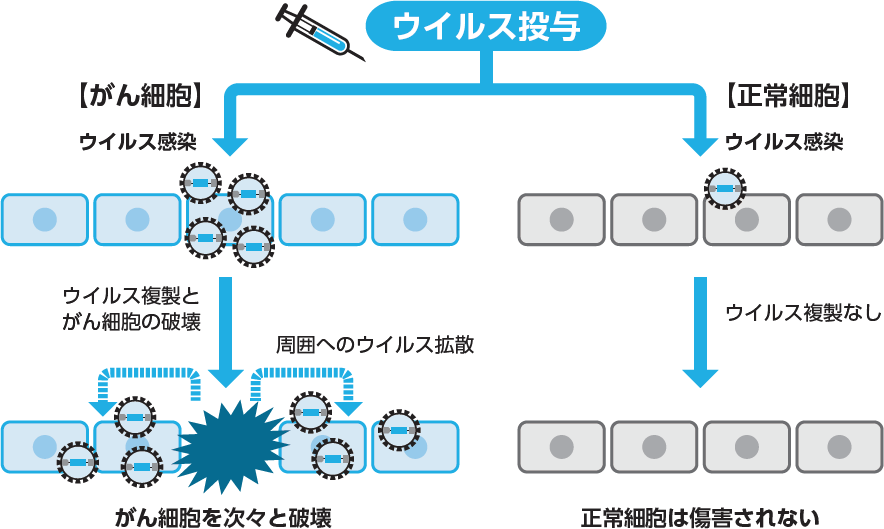
がん細胞だけで複製するよう工夫された遺伝子組み換えウイルスは,がん細胞に感染後すぐに複製を開始。その過程で感染したがん細胞を死滅させ,周囲のがん細胞にも感染を広げて次々とがん細胞を破壊する。一方で,正常細胞では複製できない仕組みを備えているため,正常組織は傷害されない。
藤堂 日本では「遺伝子治療等臨床研究に関する指針」において,疾病の治療または予防を目的とした次のいずれかに該当する行為として定義されています。
① 遺伝子又は遺伝子を導入した細胞を人の体内に投与すること
② 特定の塩基配列を標的として人の遺伝子を改変すること
③ 遺伝子を改変した細胞を人の体内に投与すること
けれども実際にはより広義な言葉として,さまざまな遺伝子を特定の細胞・組織に運搬し,効果的に標的細胞内で発現させる能力を持つ「ベクター」を用いる治療を遺伝子治療の範疇に含めるのが一般的です。具体的には,遺伝子導入を体内で行うin vivo遺伝子治療と,体外で行うex vivo遺伝子治療に大きく分けられます(図1)。
――世界で初めて行われた遺伝子治療の臨床研究は,1989年のADA(adenosine deaminase)欠損症に対するex vivo遺伝子治療でした。
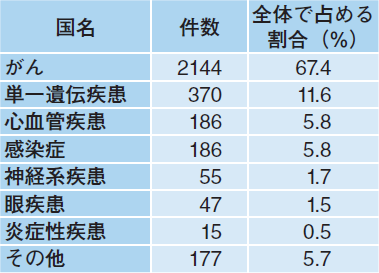
藤堂 もともとは単一遺伝疾患が遺伝子治療のメインターゲットであり,何らかの理由で遺伝子が欠損あるいは異常になっている遺伝子機能を補填することがコンセプトでした。しかし近年は技術が発展し,より患者数の多い疾患への応用が模索されています。がんを対象とした臨床試験の割合が高いのはそうした背景からです(表1)3)。
臨床応用をめざすための研究資金をいかに調達するか
――臨床試験数の割合を国別に見ると,欧米諸国が中心であり,中国の台頭も目立つ中で日本は1.5%です(表2)3)。
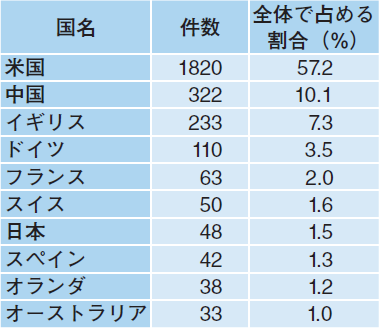
藤堂 日本は遺伝子治療開発において世界に勝る独自の最先端技術を持っているにもかかわらず,臨床応用という点では欧米に大きな遅れを取っています。最大の理由は研究費の問題です。遺伝子治療開発には,基盤技術の開発から製品化に至るまでにトータルで1000億円近く,もしくはそれ以上の費用が必要とされています。製品化への第一歩である第I相の臨床試験にたどり着くだけでも30億円程度が最低ラインと言われるものの,技術が革新的であるが故に大型の研究費が獲得しづらい現状があり,この額を獲得できる研究者は日本の中でもごくわずかです。
――欧米ではどのように研究資金を得ているのでしょう。
藤堂 革新的な技術を元手にベンチャー企業を立ち上げて第I相試験までの研究資金を投資家から調達する方法がスタンダードであり,その後の結果次第で製薬企業に開発プログラムもしくはベンチャー企業そのものを譲渡して,製品化に至る流れが大半です。
一方,日本でベンチャー企業を立ち上げたとしても,ベンチャーキャピタルからの投資額は1件当たりせいぜい数千万円程度。数社から資金を募っても最低目標金額である30億円には到底及びません。日本で成功できるベンチャー企業は一握りです。
――国が拠出する研究費も豊富ではありません。
藤堂 ええ。遺伝子導入の技術を使用するという点で原理的には同様である再生医療研究に対しては潤沢な研究費がつきますが,遺伝子治療研究はいまだ少額のままです。やはりiPS細胞の技術が日本で誕生し,ノーベル賞を受賞した影響が大きいでしょう。
――ベンチャー企業が数十億円規模の研究費を調達しにくい現在,国が研究を支援するしかないのではありませんか。
藤堂 そうなんです。つまるところ,研究費は未来への投資です。リターンが得られないこともあり得ますが,成功すれば医療や産業分野へのリターンは大きい。投資のリスクを誰が負うかという話です。日本の国力に鑑みれば対応できると信じています。
日本の遺伝子治療開発者のみに課せられる足かせ
藤堂 遺伝子治療の研究開発が遅滞している原因には規制の問題もあります。欧米では臨床研究も治験も区別なく,同一の規制当局が同一の書類に基づいて妥当性を評...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。
藤堂 具紀(とうどう・ともき)氏 東京大学医科学研究所先端医療研究センター先端がん治療分野 教授 / 日本遺伝子細胞治療学会 理事長
1985年東大医学部医学科卒。90年独Erlangen-Nürnberg大脳神経外科に留学。95年米Georgetown大脳神経外科にてHSV-1を用いたがんウイルス療法の研究を開始し,第二世代HSV-1(G207)の臨床試験にも関与。2000年米Harvard大Massachusetts総合病院脳神経外科助教授。03年に東大医学部脳神経外科講師として帰国後,翌年文科省がんTR事業に採択され臨床開発を開始する。同大トランスレーショナルリサーチセンター特任教授を経て,11年より現職。18年より日本遺伝子細胞治療学会理事長を務める。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
取材記事 2026.02.10
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
インタビュー 2026.02.10
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
