新年号特集 生殖医療と生命倫理——医学の発展は何をもたらすのか
生殖医療の未来を考える
寄稿 阿久津 英憲,林 克彦,日比野 由利
2021.01.04 週刊医学界新聞(通常号):第3402号より
生殖医療のさらなる発展によって,これからの医学研究および社会・文化はどのように変化するのか。再生医療,人工配偶子作製,第三者配偶子利用──それぞれの現状から生殖医療の未来を考える。
ES細胞を用いた再生医療の展望
阿久津 英憲
再生医療とは,病気やけがで機能不全になった組織や臓器を,再生あるいは補助する医療であり,再生医療に関連する技術は創薬などへも応用が期待されている。再生医療は,医療や生命科学研究の発展を通して難病を克服するという観点だけではなく,新たな医療産業分野を生み出す可能性についても期待される。
ヒト胚性幹細胞(Embryonic Stem Cells:ES細胞)は1998年に樹立が報告された。2010年には米国で脊髄損傷患者に対する臨床試験が開始され,ヒト多能性幹細胞による再生医療が現実となり10年が経過した。本稿では,ES細胞を用いた再生医療の開発について概説しその期待と課題を述べる。
幹細胞の中でのES細胞の位置付け
幹細胞は,自己複製能(増殖能)と分化能を持つ細胞であり,その分化能の程度や細胞増殖能により,①個体を組織(外胚葉,内胚葉,中胚葉)するあらゆる細胞に分化できる分化多能性幹細胞(pluripotent stem cells),②分化が特定の胚葉組織に限られる多能性幹細胞(multipotent stem cells),そして③分化能がさらに限定された幹細胞(oligopotent stem cellsなど)の3つに大きく分類できる。
②に分類される体性幹細胞(adult stem sells)または組織幹細胞(tissue specific stem cells)は,生体内の組織や臓器内に存在する幹細胞であり,通常,臓器・組織が機能的に働き維持されるための極めて重要な役割を担う。体性幹細胞は,自己複製能はあるものの増殖能力には限界があり,分化能も特定の胚葉組織に限られる。すでに再生医療の分野で活用されている体性幹細胞として間葉系幹細胞(mesenchymal stem cells)または間質系幹細胞(mesenchymal stromal cells)がある。
一方①に分類されるES細胞は,無限に細胞増殖する自己複製能,かつあらゆる組織へ分化する能力を併せ持つ幹細胞である。胚盤胞の分化多能性の集団である内部細胞塊より,特定の細胞培養条件下で樹立される(図)。ヒトES細胞の樹立には受精胚が用いられるため,日本では「ヒトES細胞の樹立に関する指針」1)の下,慎重に執り行われる。具体的には,不妊治療の過程で治療に用いられなくなった凍結保存胚を,提供者に対する適切なインフォームド・コンセントの施行の上で利用するものと規定している。またヒトES細胞を用いた研究は,ES細胞使用に関する研究のガイドラインに則り,各施設で承認後,文科省への届出が義務付けられた。現在では100件以上の研究が登録されている2)。
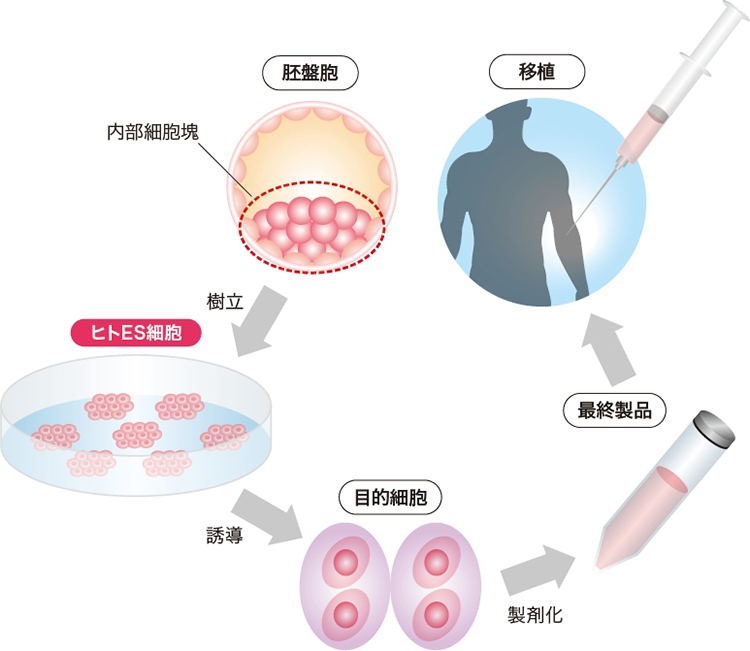
受精卵が細胞分裂してできた胚盤胞の中から細胞の塊(内部細胞塊)を取り出し,特殊条件下で培養するとES細胞が樹立される。その後,目的の細胞となるよう分化誘導し,製剤化の上,患者へ移植する。
世界に先駆けた日本の再生医療研究の支援体制
こうして研究開発がなされた再生医療を臨床応用へとつなげるため,日本では2つの法制度上の体制が整えられている。1つは,臨床研究や自由診療として実施する再生医療を対象とする「再生医療等の安全性の確保等に関する法律」(再生医療等安全性確保法)。もう1つは,再生医療の実用化に対応できるよう,再生医療製品の特性を踏まえた承認・許可制度が新設された「医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律」(医薬品医療機器等法)である。本法の成立により,日本では再生医療製品の早期承認制度が導入され,多くの再生医療製品をより早く上市するための仕組みが出来上がった。これらは世界に先駆けた革新的な制度と言えよう。
当センターでは,有毒なアンモニアを体内で分解できない先天性尿素サイクル異常症の新生児患者に対し,患者が根治療法となる肝移植を無事に行える生後3~5か月までの「橋渡し治療」として,ES細胞由来の肝細胞を移植する医師主導治験を実施した。肝臓を対象とするES細胞を用いた臨床試験として世界で初めて成功し,無事にその後の肝移植も実施し得た3)。本例が成功したことで,今後は肝移植までたどり着けなかった新生児を,より安全に肝移植の段階までつなげられることが期待されている。
世界のES細胞再生医療の現状
海外でのES細胞を用いた再生医療研究の進展はどうか。冒頭でも述べたように,次世代の医療として期待されるヒト多能性幹細胞を用いた再生医療は,2010年,世界初の脊髄損傷に対する臨床試験によって始まった。現在までに亜急性胸部脊髄損傷,網膜性疾患,インスリン依存性糖尿病,重症心筋梗塞やパーキンソン病などに対して米国,カナダ,英国,仏国,韓国,中国,イスラエル,オーストラリア,ブラジルで治験が実施されている4)。
いくつか海外における治験実施例を提示する。亜急性胸部脊髄損傷に対する再生医療は,ES細胞から分化誘導したオリゴデンドロサイト前駆細胞株をES細胞再生医療製品(AST-OPC1)として患者の損傷部位へ移植する治療法であり,現在までに20症例以上に行われた。
また2011年から眼科領域では,若年性遺伝性黄斑ジストロフィー症(スタルガルト病)と萎縮型加齢黄斑変性症の2疾患に対する臨床試験が実施されている。これらはES細胞から網膜色素上皮細胞を分化誘導することでES細胞再生医療製品(MA09-hRPE)を作製し,移植に用いている。移植を受けたそれぞれ9症例,計18症例に対する臨床試験の成果がLancet誌に掲載され5, 6),移植手技と細胞自体の安全性に大きな問題はなく,さらに移植を受けた半数以上の患者視力で若干の改善が認められたと報告された。
再生医療の研究の進展が生み出すさらなる医学の発展
ES細胞再生医療がアンメット・メディカル・ニーズへ適応するアプローチとして,患者数は一定数存在するものの治療薬がないケースと,希少疾患,難病に対するオーファンドラッグに類するケースが想定される。これらのケースに対するES細胞再生医療製品の開発は,まず安全性の検証がなされ,そして有効性の評価が行われる。しかし,グローバルにみても開発状況は初期段階にあるものが多く,開発にかかる費用や時間,労力は非常に大きい。
とはいえ,上述したように日本は世界に先駆け再生医療に特化した法律が整備され,今後ますますの発展が期待できる可能性を秘める。ES細胞関連に限っても,ES細胞の樹立から基礎研究,そして再生医療の開発と臨床利用を適切に行うための法令が整備されてきた。また近年,幹細胞を用いた疑似臓器(オルガノイド)を作製する研究も進む。将来的には,再生医療的観点から臓器を代替するというレベルにまで至る次々世代の再生医療としての研究開発の意義は大きいだろう。
再生医療は,幹細胞生物学,発生学などの基礎医学研究の進展と,臨床上...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

阿久津 英憲(あくつ・ひでのり) 国立成育医療研究センター研究所 再生医療センター生殖医療研究部 部長
1995年弘前大医学部卒後,福島県立医大産婦人科へ入局。99年米ハワイ大医学部柳町隆造研究室研究員。米国立老化研究所,米ハーバード大分子細胞生物学部研究員を経て,05年国立成育医療研究センター研究所生殖・細胞医療研究部生殖技術研究室室長。14年より現職。内閣府総合科学技術・イノベーション会議生命倫理専門調査会専門委員,内閣府「ヒト胚の取扱いに関する基本的考え方」見直し等に係るタスク・フォース構成委員等を務める。

林 克彦(はやし・かつひこ) 九州大学大学院医学研究院 応用幹細胞医科学講座 ヒトゲノム幹細胞医学分野 教授
1996年明治大農学研究科修士課程修了。東京理科大生命科学研究所助手〔2004年博士(理学)取得〕,大阪府立母子保健総合医療センター(当時)常勤研究員を経て,2005年英ケンブリッジ大ガードン研究所博士研究員。09年京大大学院医学研究科講師,12年同大准教授。14年より現職。

日比野 由利(ひびの・ゆり) 金沢大学医薬保健研究域 医学系環境生態医学・公衆衛生学 助教
東京都立大大学院社会学科学研究科博士課程単位取得退学。専門は生命倫理学,社会学。「生殖医療ツーリズム」と呼ばれる,海外でビジネス化される卵子提供や代理出産の実態を調査研究する。『ルポ生殖ビジネス――世界で「出産」はどう商品化されているか』(朝日新聞出版)など著書多数。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
医学界新聞プラス
[第4回]高K血症――疑うサインを知り,迅速に対応しよう!
『内科救急 好手と悪手』より連載 2025.08.22
-
子どもの自殺の動向と対策
日本では1 週間に約10人の小中高生が自殺している寄稿 2025.05.13
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
最新の記事
-
2026.01.13
-
新年号特集 免疫の謎を解き明かす カラー解説
マウスとヒトの知見が交差する免疫学寄稿 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ノーベル生理学・医学賞 受賞記念インタビュー
制御性T細胞が問いかける,自己と非自己の境界線対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
ヒト免疫の解明は医療に何をもたらすのか対談・座談会 2026.01.13
-
新年号特集 免疫の謎を解き明かす
臨床免疫学が迎えるパラダイムシフトインタビュー 2026.01.13
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。




