新年号特集 医薬品開発の未来を展望する
国民に最新の医薬品を届けるために
対談・座談会 藤原 康弘,城 克文,上野 裕明,山本 晴子
2025.01.14 医学界新聞:第3569号より

サイエンスの進歩に伴い新規モダリティの医薬品開発が台頭する中,日本は世界の流れに後れを取っているのが現状だ。加えて,海外で開発された新薬に関しても,日本への導入に遅れが生じる,ないしはそもそも導入されないというドラッグ・ラグ/ロスの問題が生じている。そうした課題を解消し,治療法を求める全ての患者の期待に応えて最新の医薬品を速やかに届けるにはどのような対応が必要となるのか。PMDA理事長として創薬に関する課題に日々対峙する藤原氏を司会に,製薬,行政,臨床研究に携わる3氏を迎えた座談会で議論した。
藤原 本日は,最新の医薬品を国民に迅速に届けることをメインテーマに,日本の創薬に関する現状・課題の確認からその解消策,その他関連する話題まで幅広く議論を展開したく,お集まりいただきました。製薬会社の立場からは上野さん,行政の立場からは城さん,臨床医の立場からは山本さんにそれぞれお話しいただければと思っています。どうぞよろしくお願いいたします。
モダリティの変化と立ち遅れた日本
藤原 初めに,創薬を取り巻く日本の現状と課題を確認したいと思います。なお,ここでは日本発の新薬について取り扱います。また,“創薬”という言葉は広い意味を持つため,今回の議論では,医学だけではなく理学・工学・薬学を含むアカデミアから創薬シーズ(註1)が生まれやすい環境をいかに整備するのかという点と,生み出されたシーズをいかに実用化につなげるのか,実用化に企業がどのように介在していくのかという点,その両者を含めた営みとしてとらえたいと考えています。
まずは上野さんからお願いできますか。
上野 われわれ製薬企業は新薬を創製することを目的とした集団ですから,有効な治療薬のない疾患領域に対して新薬を作っていくことが第一の使命だと考えて日々活動しています。そうした中で現状最も大きな課題として,サイエンスの進歩に伴う創薬モダリティ(註2)の変化に対し日本が立ち遅れたことが挙げられます。以前は化学をベースとした低分子モダリティが創薬の中心でしたが,近年では遺伝子治療,核酸医薬,再生・細胞医療,mRNAワクチンといった多様な新規モダリティが台頭してきています(表)。日本の製薬企業も新規モダリティへの注力を始めていて,まだ十分とは言えないものの,革新性があると世界的に評価される製品(中外製薬のヘムライブラ®,第一三共のエンハーツ®など)を創出できるようになってきています。
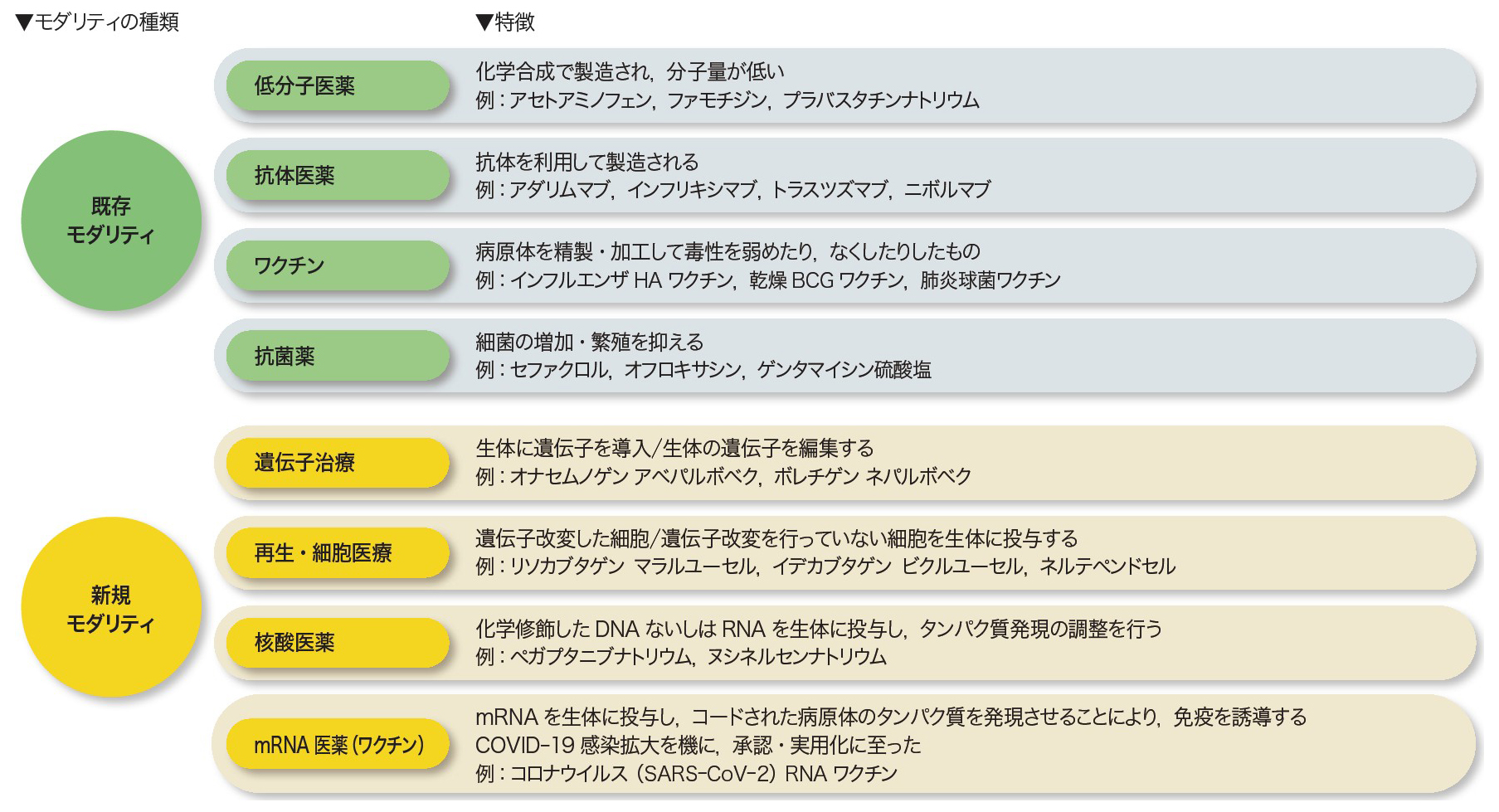
城 既存モダリティである低分子医薬に関しては,日本は世界でも相当優位を占めていました。新規モダリティにおいて日本が立ち遅れた理由の一つには,世界が次のモダリティへの投資を進める中,低分子医薬での優位性に甘んじて新規モダリティへの投資を先送りしてしまったことが挙げられます。加えて,新規モダリティ,特にバイオ医薬品(註3)への注目が集まり始めた当時,研究開発から製造まで,使用する設備がまるで違いますから,必要な投資額に対してリターンがそこまで得られないであろうと判断してしまったことも大きいです。蓋を開けてみれば,米国等で開発されたバイオ医薬品には非常に高い値段が付き先行投資を回収して余りあることがわかりましたが,後の祭りです(図1)。
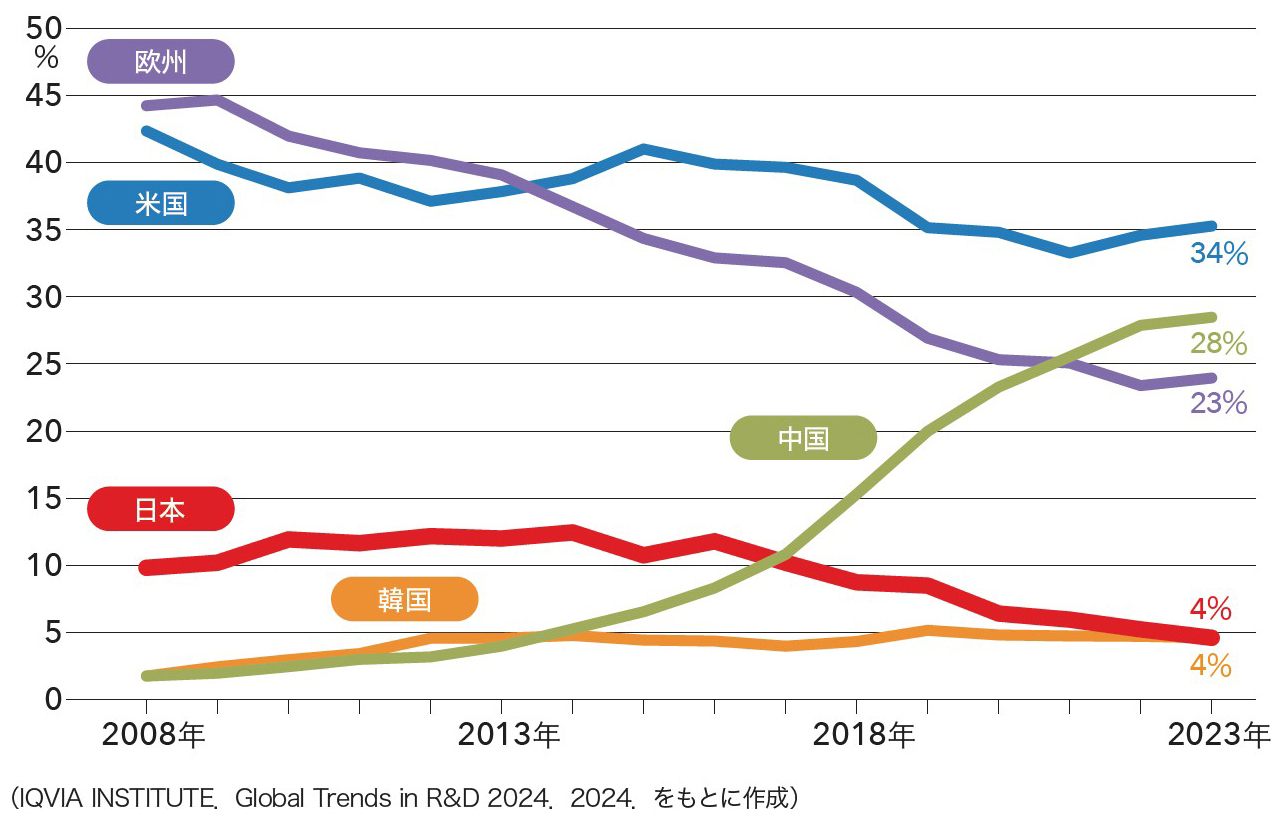
日本に本社を置く製薬企業が主導する臨床試験の割合は低下傾向にある。
藤原 しかし,上野さんもおっしゃったように,その後時間をかけて日本の産業界も徐々に追いついてきたのですね。
城 ええ。それは間違いないと思います。ただ,追いつくまでに時間がかかった分,バイオ医薬品を開発するにしてもどの領域に取り組むのかという問題が新たに発生しています。市場規模の大きい領域はすでに開発がなされていて,いま新薬が必要とされる領域は難病,希少疾患,難治性がんなどの患者数の少ないフィールドです。
また,これはそもそも論的な話なのですが,日本という国は,研究者や企業に対して日本で創薬を行う価値を本当に提供できているかを今一度問い直す段階にあるととらえています。日本が研究開発支援の環境を整えたとしても,世界中で同様の環境が整えられている中,日本の地を選んでもらえるような立地優位性はいったい何なのか。良い市場が近い,実験動物が手に入りやすい,周辺支援産業が整備されている,希少疾患の患者が存在しているなど,研究者や企業に対して,日本で創薬研究を行う意義をどうプロデュースするかを考えなければならないというのが私見です。
創薬の先にあるチェンジ・プラクティスを見据える
藤原 上野さん,城さんのお話で日本の現状を概観できたかと思います。現在は主に循環器領域で臨床に携わる山本さんの立場から,創薬に関してのご意見をいただけますか。
山本 循環器領域の場合,ガイドラインが示す各推奨クラスに治療薬が複数ありますから,病状による使い分けや組み合わせなど,薬の最適化をめざした臨床研究が重要性を持ちます。つまり,臨床研究を何のために行うのかと言えば,チェンジ・プラクティスが目的です。このひと言に尽きると思います。臨床での実践を変えていく,より良いものにして最適化する手段として臨床研究があるという考え方です。
藤原 チェンジ・プラクティスの考え方はとても重要である一方,今の日本において,その意義を特に行政側に理解してもらうのが大変な部分でもあると思います。過去の海外での大規模RCT等が医療を,世の中を変えてきた事実を伝えていく必要があるのでしょう。創薬にさえ注力していれば漠然と良い方向に変わっていくという考えではなく,創薬の先にある臨床の変化を見据える姿勢を大切にしたいです。
山本 そうですね。日本の創薬力を高めることは,実践を変えるための臨床研究において力を発揮してくれることでしょう。一方で,それは研究プロセスの後期の部分にかかわる話であって,早期の部分における創薬力というものを煎じ詰めると,知的財産(以下,知財)の獲得と言えるのではと考えています。創薬力を強化したいのであれば,医学ではなく化学・生物学のフィールドでシーズをたくさん作り,その中から実用化できそうなものをどんどん世に送り出して,知財を獲得していくのが一案ではないでしょうか。知財を押さえてライセンス収入が日本に流れるスキームさえ作ってしまえば,わざわざ第Ⅰ相試験を行うことが難しい日本国内で開発せずとも他国で行ってもらっていいわけです。米国ベンチャーが自国内で資金調達して開発してくれてもいいでしょう。
藤原 早期段階での知財を押さえるといった考え自体に異論があるわけではないですが,同時に,自身の過去の体験から肝に銘じていることを思い出しもしました。20年ほど前に米国臨床腫瘍学会(ASCO)の国際委員会委員を2年間務めた際のことです。学会ボードメンバーは患者会からさまざまな形で批判を受けたのですが,私が指摘されたのは,「日本人は欧米人患者が参加した臨床試験のデータをそのまま取り入れるばかりで,自分たちでは全然汗をかいていないじゃないか」といったことでした。その体験から,研究者として国内での臨床試験に積極的に取り組むとともに,自身が何か病気を患った際には患者として臨床試験に参加しようと思ってきました。ですので,知財を押さえて開発研究は海外でという割り切りに関しても,同様の批判を浴びることになるのではと考えてしまうわけです。
山本 日本人がフリーライダーになるという話ですね。自らが受益する分に相当するだけの持ち出しをすべきだという公正(justice)の原理は研究倫理原則に含まれますが,重要だと感じます。どのような形で創薬力を高めていくべきなのか。その方針は,医療者はもちろん,日本社会の構成員全員で考えるべき事柄ではないでしょうか。
原薬を安定供給できる体制を自国内に
上野 創薬力を煎じ詰めると知財との話はその通りだと思います。同時に,研究プロセス全体における日本の強みも捨てたものではないとの思いもまたあります。創薬に関して,日本の国際的な地位が相対的に落ちてきているのは確かですが,それでもまだ世界有数の創薬大国の一つであることに変わりはないです。医療用医薬品世界売上で上位100品目の国別起源を比較すると,いまだに5本の指に入るくらいの力はありますから。これは重要な事実です。医薬品を実用化するまでには実にさまざまなプロセスが存在していて,それらをハイレベルに,かつうまく組み合わせて行えるところに日本の強みがあるはずです。加えて,日本でしっかり治験をして薬事承認を取る,それも世界で初めて取れるような体制も整っている。それが可能な国は世界の中でも限られているわけで,その立場をやすやすと明け渡してはならないだろうとの思いがあります。そして,それは若い人の人材育成にもつながるはずです。
藤原 城さんは先ほど日本で研究開発を行う意味がそもそもあるのかを考えるべき段階にあるとのお話をされていましたが,お二方の話を聞かれていかがでしょうか。
城 研究開発の場として日本が企業に選ばれないことにはどうしようもないとは,やはり考えています。研究開発を担う企業側から見た日本の不利な点は国民皆保険制度があることです。全国どこの医療機関を受診しても一定水準の医療を低価格で受けられることは国民にとって良いことなのですが,患者の分散によりデータが集めにくいことに加えて,保険が適用される有効性の担保された医療を受けたいとの選好を患者が持つようになるため,新薬開発の場としては厳しいと言わざるを得ません。それでもなお開発の場として選んでもらうには,手間なく・手早くデータに基づいた審査・承認を行うなどの環境整備は大前提ですし,実際にそうした薬事面の整備はここ数年かなり進んでいます。その上で,プラスアルファのメリットを示していく必要があるでしょう。
藤原 薬事面の整備については,ドラッグ・ラグ/ロスの解消にもかかわってくるポイントですね。
製造プロセスの話に関連して,原薬の話題も取り扱っておきたいです。COVID-19感染拡大時に問題になりましたが,今はインド・中国での製造がほとんどで日本は原薬製造に弱いとの意識があります。実際のところどうなのでしょうか。
上野 弱いというと語弊があるかと思います。本来は原薬製造にも強いのだけれど,効率性を求めて安価な原材料に関しては海外に製造拠点をシフトし,自国ではより高価な医薬品製造に注力したという経緯があるからです。製造拠点をシフトした当時の製薬業界の経営効率を考えるとそうならざるを得なかった側面があったと思います。
しかしその方針は今では見直され,海外にシフトした原薬製造を今一度国内に呼び戻そうとの動きがあります。一連のバリューチェーン(患者の手元に医薬品が届くまでの流れ全体)を日本国内で持たなければとの考えによるものです。
城 原薬製造に関しては,大規模な有機・無機の化学合成を行ったり爆発性の原料を扱ったりする関係上,環境負荷が非常に大きいという特性があります。そのため,海外に原薬製造の拠点を移した是非はともかく,世界的に見て環境面の規制が緩やかな地域,広大な用地が確保できる地域,人口密度が低い地域などに主要な製造拠点が置かれ,それが規制強化や地域の発展に伴って別の規制の緩い地域へと移り変わってきた流れがあります。今では世界的に原薬は中国に大きく依存する状況になっているわけですが,最近問題とされているのは,原薬供給が止まってしまった場合にどうするのかといった経済安全保障面の懸念です。ジェネリック医薬品では安定供給のために原薬をダブルソース化(複数購買化)する取り組みを進めてきましたが,それでも大元に遡れば中国の工場にたどり着くものも多いのです。原薬は代替品をすぐに用意することが難しいものの,原薬を合成できる技術があればその原材料は世界中どこからでも手に入れやすく,差し替えも可能です。そういう意味で,自国内で原薬を安定的に合成できる体制を持っておくことは,いざという時のために必要と言えます。
ドラッグ・ラグ/ロス問題への対応
藤原 海外で開発された新薬の承認が遅れる「ドラッグ・ラグ」,そもそも新薬が国内に導入されない「ドラッグ・ロス」が近年問題となっています(図2,カラー解説記事の図2参照)。これらの問題に対してどのような対応が考えられるのでしょうか。またはどのような試みがすでになされているのでしょうか。
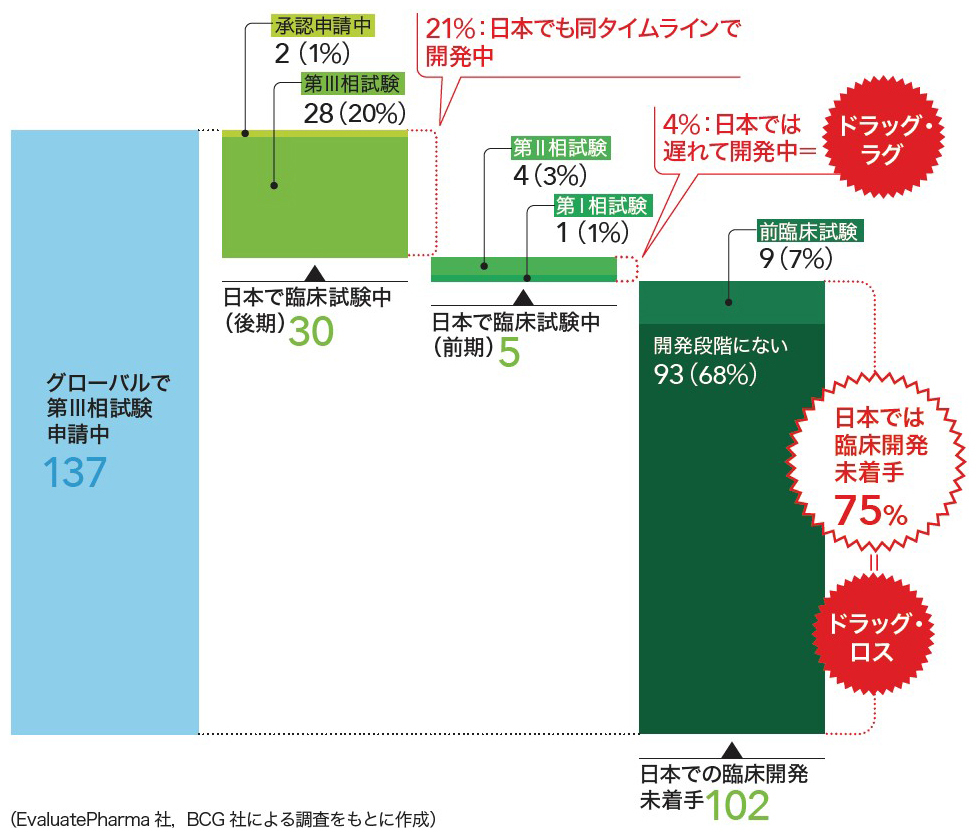
2023年7月時点でグローバル(欧米)において第Ⅲ相試験申請中の新規モダリティ医薬品137点の,日本での開発状況を示す。そのうちの102点(75%)は日本での臨床開発が未着手(ドラッグ・ロス)であり,今後さらに拡大する懸念がある。なお,集計は製品名単位で行い,複数Indicationを持つ場合は最初の承認年を参照している。
上野 日本の製薬企業の立場からしますと,海外で開発された新薬をあまり遅くならないうちに国内でも販売するというのは至って普通のプラクティスです。業界としては,海外から新薬を日本にいかに導入しやすくするかを念頭に置いて活動をしていくということになります。その一つが薬事制度,薬価制度の両面での環境整備ですね。
城 厚労省では,「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」を2022年8月より継続的に行い,検討結果を取りまとめました1)。厚労省内の所管にかかわらず,必要なことをパッケージとして提案したものです。取りまとめを受けて薬価制度,薬事制度,産業政策などそれぞれの分野で対策が取られています。
具体的な取り組みとしては,例えば薬価制度では,成人と同時開発する小児用医薬品の加算の充実や,国際的に見て日本に早期導入した品目の加算の拡大などの対応を行っています。薬事制度でも,希少疾病用医薬品の指定の早期化や,海外で臨床開発が先行した医薬品の第Ⅰ相試験の原則不要化,海外で検証的な臨床試験が完了している極めて患者数の少ない疾患用医薬品の日本人試験の不要化などの対応を行っています。
このように薬事,薬価ともに障害を取り除く実際的な対応を重ねてきていますので,企業にしっかり取り組んでもらえればドラッグ・ラグ/ロス解消に向けて良い方向に進んでいくと考えています。なお,ドラッグ・ラグ/ロスの品目については,これまでの国内からの要望に基づくものだけでなく,行政側がリストアップして企業に国内開発を要請する仕組みも新たに始めています。
山本 循環器領域では患者数が多く頻用されるような医薬品でドラッグ・ラグ/ロスはありません。あるとすれば,超急性期脳梗塞治療に用いられるテネクテプラーゼのように使用頻度が低い医薬品ですが,こうした医薬品についてはドラッグ・ラグ/ロスどころか米国ですら企業治験は行われません。その場合は研究者主導で進めるしかないので,世界中で臨床研究ネットワークが構築されています。問題は,欧米や中国では当たり前のように疾患単位のネットワークが作られ研究資金が投入される仕組みができているにもかかわらず,国内ではそうなっていないことです。国は大学病院やナショナルセンターを臨床研究中核病院に指定し支援しているものの,薬剤投与の対象となる急性期脳卒中患者はそうした大きな施設にはほとんど入院してきません。同様のケースはCOVID-19感染拡大下でも起こっていて,多数の感染患者が入院している市中病院には治験審査委員会もなければ臨床研究コーディネーターもおらず,臨床試験をしようにもやりようがない状況でした。コモンディジーズのような大学病院が不得手とするところに研究支援の手が届かない現状があるため,その解決を望みます。
藤原 ご指摘の疾患領域ごとの臨床研究ネットワーク構築については,私もその重要性を痛感しています。コロナ禍と同じ轍を踏まないよう,今後に向けて環境整備を進めていく必要があるでしょう。
ニッチなマーケットを臨床研究がこじ開ける
藤原 先ほど城さんから,これから新薬が必要とされる領域は,難病,希少疾患,難治性がんであるとの話がありました。そうした患者数の少ない領域での医薬品開発については皆さんどうお考えでしょうか。
山本 患者の少ない難病の治療薬はビジネスとして成立しにくく企業が出資せず,臨床医が牽引しなければならないという切実な問題があるのは事実です。しかし一部の難病では,状況を大きく変える治療薬が開発されることでマーケットが拡大し,ベンチャーが次々に新薬開発に乗り込んでくるようになったという事例もあります。例えば肺高血圧症は,1990年代頃は発症後数年でほとんどの患者が亡くなる悲惨な疾患でしたが,新規治療薬により予後が改善し余命が10年,20年に延びたことで,ビジネスとして成立するようになったのです。これからは,アカデミアが難病,希少疾患治療の扉をこじ開けて,ビジネスとして成立すれば企業の資金が入ってくるようになる。ですからこうした領域での創薬推進においては,今後ますますアカデミアの臨床研究力が問われることになるのだと思います。
とは言えどうしても企業が手を出せない領域も残り続けますから,そうした領域については別途何らかの方策を要するでしょう。
藤原 日本ではオーファンドラッグ(註4)指定を受けるための基準は患者数5万人未満,米国では20万人以下ですが,それくらいの規模があれば医薬品開発にも希望が持てます。今後はウルトラオーファンドラッグと呼ばれる,数人や数百人,多くても1000人といった患者規模の疾患治療薬をどう提供していくのかが課題になってくるはずです。
上野 制度の工夫によって,希少疾患の領域に企業が参画して治療薬を届けることもできるのではないでしょうか。現行の類似薬効比較方式や原価計算方式等とは異なる新しい価値評価の在り方を確立することで,ウルトラオーファンドラッグや必要なドラッグ・ロス品を患者さんにお届けする方法があるのではないかと考えています。
城 新成分による画期的な新薬であれば,今でも開発コストや製造コストにイノベーション度合いを加味した利益率を乗せて患者数で割り戻す形で薬価を決めていますから,きちんと採算がとれる仕組みになっているはずです。リポジショニング(註5)医薬品や,新成分ではあるけれど既存の類似治療薬との比較を余儀なくされる医薬品については,別の算定ルールを,との議論はあってしかるべきだと思います。開発可能性の問題はあるにせよ,開発ができるのであれば,あとは価格の問題というのはその通りです。
一方で,そうした開発の恩恵を全く受けないけれども保険料を払い続けている国民がいることも忘れてはならないと考えます。普段はほとんど医療保険を使わないような健康な国民に対して,高額な薬剤費を負担する必然性を説得的に示せるような議論を経た上で,今健康な人たちも含めて全員にとって必要なルールの見直しであることを伝えていく必要があるのではと。
革新的医薬品ばかりに価値があるわけではない
上野 薬価に関連して言うと,海外の製薬企業からは,日本の薬価制度の問題として予見性の低さが挙げられています。薬価の再算定があるなど,先の見通しが得られないことはビジネス上リスクとしてとらえられますから。一方で,薬価算定理由の透明性や薬事承認をとってから薬価収載までの期間の短さなど,日本の薬価制度の良さと言うべき点もあります。良いところを保ちつつ,ビジネスに必要なだけの予見性が確保される制度設計をしていけば良いのではないかと考えます。
城 企業の投資判断は発売の10年以上前から複数回にわたって行われます。そうした投資の前提となった価格付けの制度をそんなに頻繁に,しかも劇的に変更するな,という話ですよね。行政は単年度会計で毎年プラスマイナスをゼロにする仕組みですから,創薬系の企業が重視する長期的な見方とは異なるものがあります。
山本 新規モダリティでの革新的医薬品の薬価算定に従来の方法がなじまなくなっているのは確かです。ただ,こうした話題を扱っていて私が思うのは,革新的医薬品ばかりが価値を持つわけではなく,日々使用しているエッセンシャルドラッグの重要性にも目を向けてほしいということ(図3)。特に循環器領域は長期収載品によって医療が維持されている側面があります。日頃コモンディジーズを多く診ている立場からは,安全性が一定程度担保されていて,使用後に起こることが10年20年といった長期スパンで予見できる医薬品,エッセンシャルドラッグを守っていきたいと思うのです。
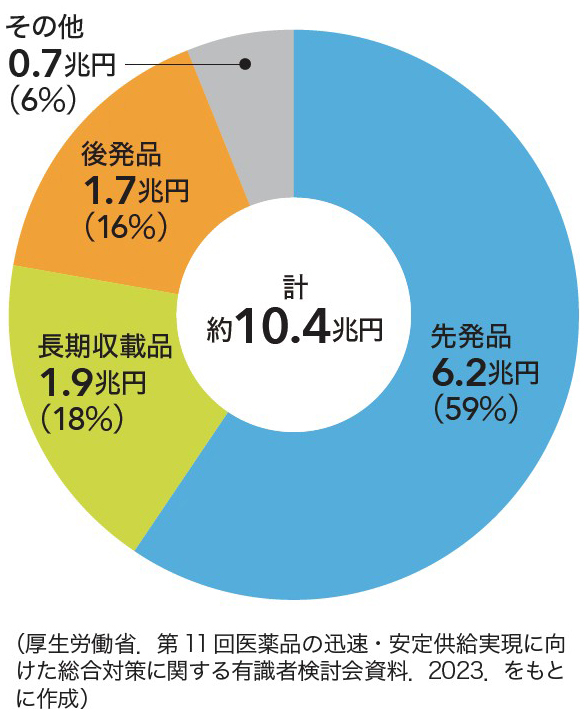
先発品のインパクトは大きいが,後発品や長期収載品の市場も小さくない。「その他」は1967年以前に収載された医薬品。
藤原 がん患者を診ていた頃,「高い薬が良い薬というわけではない。自身の疾患にとって最適ならば安い医療が一番良い医療だ」といつも言っていました。特に乳がんではサステナビリティや経済毒性(Financial Toxicity)の観点からも,長期収載品やバイオシミラーの使用を勧めます。
城 特許切れ医薬品を市場に安定的に供給していくことは極めて重要です。よく誤解されるのですが,本来特許制度は知財の保護独占を狙いとする制度ではなく,放置しておいたら隠されて世に出てこないかもしれない知財を,広く一般に普及させ使えるようにするために登録する制度です。もちろんタダで公開しろと言われても誰もしませんから,一定の独占販売期間を与えている。こうした仕組みを前提として,公開された知財に全面的に依拠することで成立するジェネリック医薬品産業については,製品が広く一般に普及するよう,安定的に供給する責務があると思います。行政側として基礎的医薬品の指定などの細かい仕組みを作ってきましたが,もうそろそろ企業側も自覚を持って提供体制を整えていただきたいと思っています。今は法令違反や原薬不足等で出荷制限がかかっている品目が多いですが,これらが全て通常通り稼働したとしても,今後のさらなる高齢化を考えれば市場はさらにひっ迫する可能性が高く,供給能力を高めていかなければなりません。政府も産業構造改革の推進を打ち出して業界再編や製造体制の大規模化などの施策を進めているところです。
上野 新薬を安定的に世に出して,特許が切れたらジェネリックに譲る。われわれ新薬を製造販売する製薬企業のビジネスモデルはシンプルで,今後も変わらないはずです。ただ,医療全体を見た際のエッセンシャルドラッグなどの安定供給については,城さんのおっしゃったように施策を国に行っていただくといったところに落ち着くと思います。
*
上野 われわれ製薬企業としては,作った薬を実際に患者さんに届けるのは医療従事者の方々にお願いすることになるわけですが,診療報酬の制約がある中で,病院経営は厳しさを増す一方かと思います。作った医薬品が患者さんに届かないのはわれわれとしても本意ではありません。病院経営が成り立つような産業政策,医療保険制度全体をどのように舵取りしていくのかを考える時期にきているのではと思います。
城 COVID-19感染拡大時に痛感しましたが,医療費抑制の要請は理解できるものの,平時に余裕のない診療体制を組んでいては,有事の際に現場が回らなくなります。しかしながら余裕をもった体制を組むにはコストが必要で,それは国民一人ひとりの負担によるものです。良い環境を享受するには相応の負担が伴うとの議論は必要だと感じています。
山本 患者さんのことを考えて日々診療に向き合う。医療者にとって最も大切なことです。しかし同時に,世の中の仕組みを知り,制度上の問題があれば声を上げる姿勢もまた大切にしてほしいです。医療技術とは別に,そうした力を磨いていくことも,これからの医療者には必要ではないでしょうか。
藤原 ドラッグ・ラグ/ロスなど大小さまざまな課題を抱える創薬について考えるとき,誰に問題があるといった言説が生じがちです。しかし,それぞれが自分自身の持ち場でできることにしっかり取り組んでいく。その積み重ねでしか事態は変わっていかないのだと思います。皆さん,本日はどうもありがとうございました。
(了)
註2:創薬技術の方法・手段。または,各方法・手段に基づいて作られた医薬品の種別。
註3:遺伝子組換えや細胞培養等のバイオ技術を用いて製造されたタンパク質を有効成分とする医薬品。
註4:希少疾病用医薬品のこと。
註5:既存の承認薬や開発中の薬を転用し,新しい治療薬として開発する方法のこと。
(文献・URL)
1)厚労省.医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会報告書.2023.

藤原 康弘(ふじわら・やすひろ)氏 医薬品医療機器総合機構(PMDA) 理事長
1984年広島大医学部卒。国立がんセンター研究所薬効試験部研究員,広島大病院総合診療部助手などを経て,米メリーランド大などで臨床薬理学,第一相試験を研鑽。97~2002年国立衛研・医薬品医療機器審査センター(現PMDA)で新薬承認審査に従事。国立がん研究センター中央病院副院長(経営担当),乳腺科・腫瘍内科長などを経て,19年より現職。

城 克文(じょう・かつふみ)氏 厚生労働省医薬局 医薬局長
1989年東大法学部卒。厚生省(当時)に入省後,保険局総務課医療費適正化対策推進室長,内閣府政策統括官(経済社会システム担当)付参事官などを経て,2013年医政局経済課長に就任。未妥結減算や基礎的医薬品の制度化に携わる。その後,保険局医療介護連携政策課長,社会保険診療報酬支払基金審議役,厚労省大臣官房医薬産業振興・医療情報審議官などを歴任。23年7月医薬・生活衛生局長に就任。同年9月医薬・生活衛生局から改編された医薬局にて現職。

上野 裕明(うえの・ひろあき)氏 日本製薬工業協会 会長 / 田辺三菱製薬株式会社 代表取締役
1981年東工大工学部卒。83年同大大学院理工学研究科化学工学専攻修了の後,三菱化成工業(現・三菱ケミカル)入社。博士(理学)。2005年創薬第四研究所(癌・肝疾患)所長,06年化学研究所所長,07年創薬第二研究所(代謝&心循環器疾患)所長等を経て,14年より田辺三菱製薬執行役員。20年代表取締役社長就任の後,22年より現職。日本製薬工業協会会長,日本製薬団体連合会副会長。

山本 晴子(やまもと・はるこ)氏 国立循環器病研究センター 理事
1988年阪大医学部卒。精神科にて初期研修後,国立循環器病研究センター脳血管内科レジデント等を経て,スイス・ローザンヌ大病院神経内科留学。2000年国立衛研医薬品医療機器審査センター(当時)にて新薬審査業務に従事する。03年より国立循環器病研究センターにて先進医療・治験推進部長,臨床研究管理部長,理事長特任補佐等を務め,20年医薬品医療機器総合機構医務管理監・理事長特任補佐。23年国立循環器病研究センターに戻り,24年より現職。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
取材記事 2026.02.10
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
インタビュー 2026.02.10
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。

