がん領域におけるオンライン治験の実際
寄稿 中村健一
2023.11.20 週刊医学界新聞(通常号):第3542号より
分散型臨床試験(Decentralized Clinical Trial:DCT)とは,オンライン治験あるいはリモート治験とも呼ばれる新たなタイプの臨床試験である。従来,患者が臨床試験に参加するには医療機関への来院が必要であったが,DCTでは全くの来院なしに臨床試験への参加が可能となったり(フルリモート型DCT),一部をリモートに置き換えることで来院回数を減らしたりすることが可能となる(ハイブリッド型DCT)。
がん領域では2019年よりがん遺伝子パネル検査が保険収載されたものの,パネル検査を受けたとしても実際に治療薬へ到達できる患者の割合は9.4%と極めて低い1)。その原因の1つが地方に在住する患者の治験アクセスの悪さである。特に希少がん,希少フラクションの治験は都市部に集中しており,地方在住の患者が頻回に都市部まで通院して治験に参加することには,時間的,経済的,身体的に大きな負担が伴った。DCTは,こうした地方在住の患者における治験へのアクセスを劇的に改善させる手法として期待されている。
フルリモート型DCTのメリットとは
DCTの良い適応となるのは,①アクセス面での制約がある場合(例:患者が遠隔地に在住,高齢者や障害を持つ患者で移動が困難),②患者が医療機関を訪れることがリスクとなる場合(例:コロナ禍での来院),③ウェアラブルデバイスやスマートフォンを介した情報収集が適している場合(例:患者自身が報告するQOLがアウトカムである場合)などが挙げられる。DCTは米国を中心に,移動に困難を抱える精神神経疾患患者等に対して行われてきたが,日本でもコロナ禍を契機に初診からのオンライン診療が可能となり,各領域で試みられるようになった。がん領域でも,2022年より愛知県がんセンターで,医師主導治験によるフルリモート型DCTが開始となり2),23年からは国立がん研究センター中央病院(以下,国がん中央)においても,希少がん医師主導治験に対してフルリモート型DCTが導入された。
国がん中央で実施しているフルリモート型DCTの仕組みを図に示す。従来,地方在住の患者が国がん中央の治験に参加するにはビジットごとに東京まで何時間もかけて通院する必要があった。しかし,フルリモート型DCTではオンライン診療で国がん中央と患者自宅近隣のパートナー施設を結び,患者は東京に来ることなく治験への参加が可能となる。治験参加への同意はeConsentと呼ばれるシステム上でデジタルサインを行うことによってなされ,治験薬(経口薬)は国がん中央から患者宅へ直接配送される。一方,治験で必要な血液検査や画像検査等は患者が自宅近隣のパートナー施設を受診する形で実施し,検査結果はパートナー施設から国がん中央へ共有される。この仕組みにより,患者は自宅近隣を離れることなく遠隔地から治験への参加が可能となる。
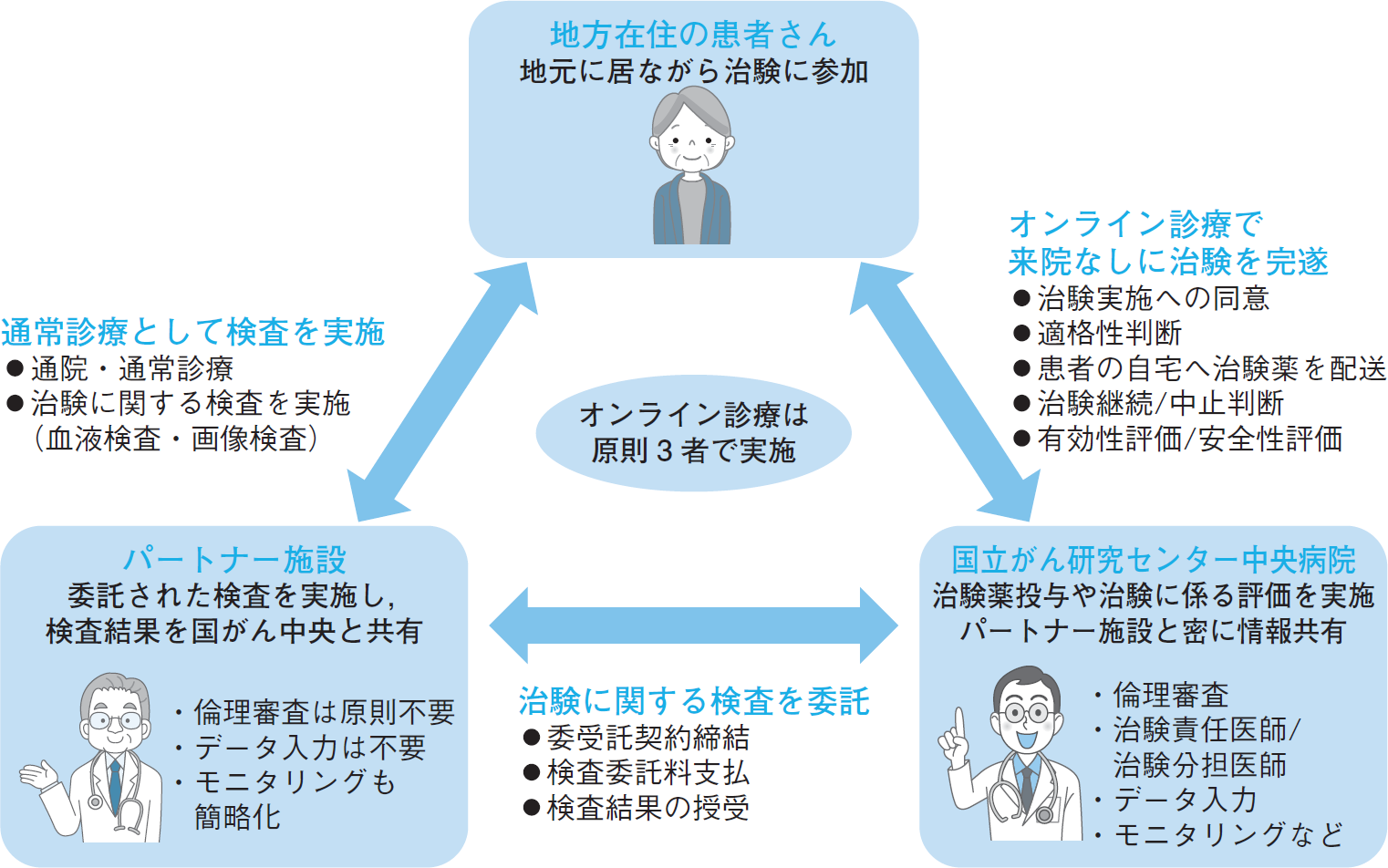
なお,このパートナー施設は,「医薬品の臨床試験の実施の基準に関する省令」(GCP省令)39条の2に定められた委受託契約により,検査等を委託された施設との位置づけとなる。つまり治験実施機関には相当しないため,倫理審査を受ける必要はなく,治験責任医師や治験分担医師としてのトレーニングも免除される(委託業務を遂行するため...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

中村 健一(なかむら・けんいち)氏 国立がん研究センター中央病院 国際開発部門長
1999年京大医学部卒業後,関連病院で7年間外科医として勤務。2006年より国立がん研究センター中央病院で日本臨床腫瘍研究グループ(JCOG)の運営・管理に当たる。15年には同院で医師主導治験の支援部門を立ち上げ,日本最大規模の支援機能を有する組織を構築。20年より現職。アジア臨床試験ネットワーク構築やDCT実装,治験に関する規制要件の政策提言等を行う。横市大および広島大客員教授。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
医学界新聞プラス
[第10回]外科の基本術式を押さえよう――腹腔鏡下胆嚢摘出術(ラパコレ)編
外科研修のトリセツ連載 2025.03.24
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
