薬剤が及ぼす腸内細菌叢への多大な影響
日本人4198例の腸内マイクロバイオーム解析の結果から
寄稿 永田尚義
2023.01.30 週刊医学界新聞(通常号):第3503号より
世界に類を見ない情報量と多数例のデータベースを構築
さまざまな環境因子や宿主因子が腸内細菌叢に影響を及ぼすことが示唆されており1~4),その変化がヒトの健康維持と病気の発症に密接に関与している可能性が指摘されている5)。ヒト腸内細菌叢に影響を及ぼし得る環境因子には,国,地域,食習慣,運動習慣,アルコール,喫煙,抗微生物薬投与,手術などが1~4),宿主因子には,宿主遺伝子の他,年齢,性別,体格,人種,さまざまな疾患,便形状,免疫状態,栄養状態,睡眠などが挙げられる1~4)。
ヒト腸内細菌叢は,個人間の多様性が極めて高いため,「どのような因子が腸内細菌叢に影響を及ぼすか」を明らかにするには十分な被験者数が必要である。1000例以上の大規模腸内細菌研究は欧米を中心に報告されていたが1~4),日本人での検討は皆無であった。このような背景の中われわれは,日本人4198例を対象に詳細なメタデータとマイクロバイオームデータを統合した大規模データベースを構築し,Japanese 4D(Disease,Drug,Diet,Daily life)マイクロバイオームコホートと命名した(図a)6)。メタデータには,多彩な疾患や薬剤情報,食習慣,生活習慣,身体測定因子,運動習慣などが含まれ,特に薬剤に関しては759種類の薬剤投与歴を網羅的に収集している6~9)。
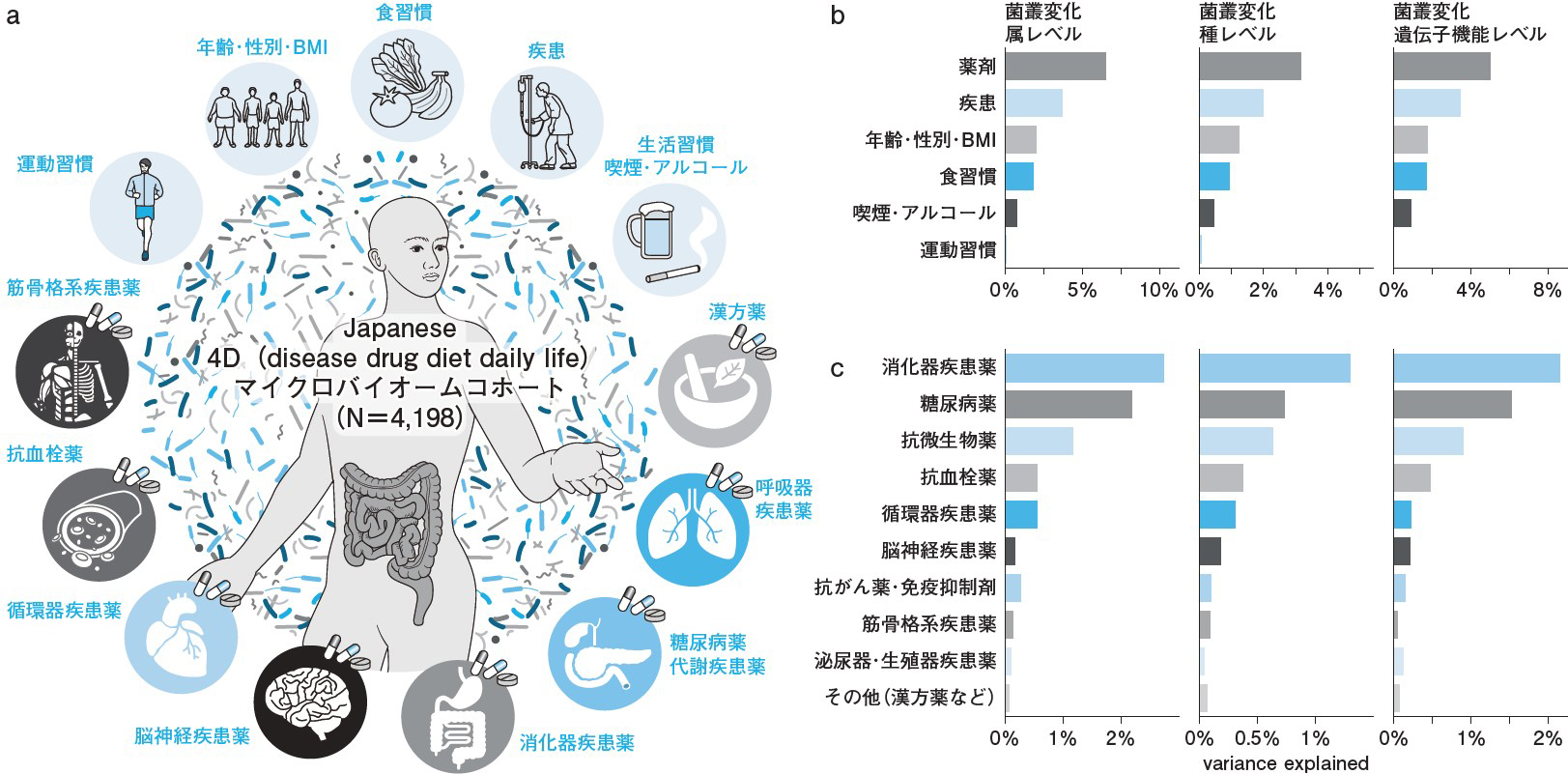
集められた糞便サンプルに対しショットガンメタゲノム解析を行ったところ,日本人の腸内細菌1773種(種レベル),腸内細菌の遺伝子機能1万689個,薬剤耐性遺伝子403個,1347種のバクテリオファージ(約半数は新規のファージ)を同定6, 9)。また,日本人の腸内にはBacteroides,Bifidobacterium,Clostridiales,Blautia,Faecalibacteriumなどの菌種(属レベル)が多いことを大規模データから明らかにした6)。このような膨大な生活習慣・臨床情報とマイクロバイオーム情報を統合したデータは,世界の中でも最も大規模なものの1つである。
日本人の腸内細菌叢に最も影響を与えるのは薬剤投与
日本人4198例の腸内細菌叢の解析から,さまざまな環境・宿主因子の中で薬剤投与の腸内細菌叢への影響が最も強く,次いで疾患,身体測定因子(年齢・性別・BMI),食習慣,喫煙・アルコール,運動習慣の順であることが明らかとなった(図b)6)。薬剤が及ぼす影響は食習慣,喫煙・アルコール,運動習慣より3倍以上も強く,この影響度の強さは,腸内細菌叢を属,種,遺伝子機能等のさまざまなレベルで解析しても同じ結果であった(図b)6)。この結果は,ヒトマイクロバイオーム研究における「薬剤情報の収集の重要性」と「薬剤投与歴を考慮した解析の必要性」を強調するものと言える。
また,多変量解析にて消化器疾患薬,糖尿病薬,抗微生物薬,抗血栓薬,循環器疾患薬,脳神経疾患薬,抗がん薬・免疫抑制剤,筋骨格系疾患薬,泌尿器・生殖器疾患薬,その他(呼吸器疾患薬や漢方薬)の順で影響が強いことが判明した(図c)。特に,消化器疾患薬の中ではPPI(Proton-Pump Inhi...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

永田 尚義(ながた・なおよし)氏 東京医科大学消化器内視鏡学 准教授
2002年関西医大卒。国立国際医療研究センターでの研修を経て,04年同センター消化器内科。19年より現職。ヒトの口腔内および腸内マイクロバイオームと詳細なメタデータを統合したJapanese 4Dデータベースを構築し,臨床医の視点からヒトマイクロバイオーム研究に携わる。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
対談・座談会 2020.02.03
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
医学界新聞プラス
[第10回]外科の基本術式を押さえよう――腹腔鏡下胆嚢摘出術(ラパコレ)編
外科研修のトリセツ連載 2025.03.24
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
