プログラム医療機器の普及促進を
対談・座談会 黒田 知宏,田中 志穂,佐竹 晃太
2022.02.21 週刊医学界新聞(通常号):第3458号より

大量の画像データを学習した診断支援ソフトウエアやニコチン依存症に対する治療用アプリが登場するなど,近年デジタルヘルスの分野が盛り上がりを見せる。治療や診断,予防を目的に開発されるこれらは「プログラム医療機器」と総称され,2020年には厚労省がプログラム医療機器実用化促進パッケージ戦略(DASH for SaMD)1)を打ち出し,実用化に向け国を挙げて体制強化の方針を示している。一方で,「ソフトウエアの活用によって実現し得る社会の在り方と,実際の医療の枠組みの間には大きなギャップがまだまだ存在します」と黒田氏が語るように,臨床現場でのさらなる普及には乗り越えるべき課題が山積みだ。プログラム医療機器の現在地と今後日本が取るべき針路とは。3人の識者が議論を深めた。
黒田 スマートフォンなどの情報機器が広く普及している今日,それらを用いたデジタルヘルスが急速に成長しています。特に診断・治療・予防を主目的にしたプログラム医療機器に対する医療従事者の注目度は高いのではないでしょうか。電子カルテシステムの構築など,コンピュータ・サイエンティストとして医療を支援してきた私自身も,この分野がどのような発展を遂げていくのかに大変興味があります。
本日は,業界団体である医療機器産業連合会(以下,医機連)の代表として田中志穂さんに,また治療用アプリとして日本初の医療機器承認を得たCureApp社から佐竹晃太さんに参加いただきました。プログラム医療機器の現状と課題の整理を中心に議論を深めていければと思います。
そもそもプログラム医療機器(SaMD)って何?
黒田 議論に先立って,「プログラム医療機器とは何か」という話が必要でしょう。田中さんより説明していただけますか。
田中 厚労省通知では「医療機器としての目的性を有しており,かつ,意図したとおりに機能しない場合に患者(又は使用者)の生命及び健康に影響を与えるおそれがあるプログラム」2)とされ,SaMD(Software as a Medical Device)とも呼称されます。例えば,AIを用いたSaMDとして日本で初めて承認された内視鏡画像診断支援ソフトウエアEndoBRAIN®-EYEや,CureApp社が開発したニコチン依存症治療のためのアプリ,Apple Watchの心電計機能を用いた診断支援などが該当します。一方で,日常の健康増進活動支援などを主目的にした健康・医療ソフトウエアはnon-SaMDとも呼ばれ,フィットネスアプリなどを指します。
黒田 SaMDの中でも,医療機関内で医療従事者が主に用いる製品と,アプリなどを媒介に患者個人が利用する製品に分かれていますよね。医療従事者の作業効率や診断能の向上を期待できる前者も大変有用だとは思いますが,個人に直接リーチする後者のほうが,今後の医療の裾野を広げる上では重要だと私は考えています。治療用アプリの開発で日本の先頭を走るCureApp社の状況を教えてください。
佐竹 現在当社では,ニコチン依存症をはじめ,高血圧や非アルコール性脂肪性肝炎(NASH),アルコール依存症患者の行動変容を促すアプリ開発を進めています。最近ではがんや慢性心不全に対するリハビリテーションを促すアプリ開発もスタートさせたところです。
黒田 なぜニコチン依存症を最初のターゲットとしたのでしょうか。
佐竹 私はもともと呼吸器内科医であり,禁煙治療の際,患者さんに対して行動変容を促しアドヒアランスを高める重要性を常々感じていたからです。2014年の創業時から開発を始め,慶應義塾大学病院呼吸器内科と共同で臨床研究や治験を行い,2020年に治療用アプリとしての日本初の薬事承認と,保険適用を受けました。同治療法は,関連4学会が定めたガイドライン「禁煙治療のための標準手順書(第8.1版)」3)にも,標準治療の一つとして位置付けられています。
SaMD開発のハードルが高い理由とは
田中 現状,日本における治療用アプリ開発の中心にいるのはスタートアップ企業ですが,製薬企業,IT系企業の参入も今後ますます期待されています。また医療機器メーカーでも,術後管理の方策の一つなど,アプリを新たな分野へ応用できないかと考える企業もあるようです。
黒田 ビジネスチャンスと感じている企業が多い一方で,「non-SaMDの開発には取り組みたいが,SaMDの開発はハードルが高いために扱えない」と,企業の担当者から耳にすることがしばしばあります。背景にある理由について,医機連ではアンケート調査を実施されたようですね。
田中 医機連の加盟企業に対し2021年5月にアンケート調査を行ったところ,下記の課題を各フェーズにおいて感じていることがわかりました。
開発フェーズ
●データ収集時における個人情報の取り扱いのハードルが高く,時間を要する
●投資費用が回収できるか不透明で,ビジネスモデルが立てにくい
薬事・審査フェーズ
●医療機器への該当性判断に悩む事例が多い
●有効性の評価方法や申請書の記載方法など,審査要件が不透明でわかりにくい
市販後フェーズ
●変更に迅速に対応できるよう医療機器変更計画確認申請(IDATEN)制度4)が策定されたが,対応に難渋する点がある
●現行の医療保険制度では,医療の効率化に貢献するSaMDの特性を評価しきれない
黒田 ありがとうございます。それでは各フェーズで挙がった課題に沿って議論を進めていきましょう。まずは「開発フェーズ」の課題について詳しく聞かせてください。
田中 SaMD全般を見渡すと,近年はAI技術を応用した医療機器開発が進んでいます。開発に当たっては個人情報保護法や臨床研究法,倫理審査などについて検討が必須であるものの,それぞれ個人情報の取り扱いに関する判断に若干の差異があり,現場を混乱させています。中には研究段階で収集したデータが承認審査の際に使用できず,同意の取り直しとなるケースもあるようです。課題の整理のために厚生科学審議会でも継続的に議論を重ねていますが,メーカー側が感じる課題を払拭するには至っていません。
また,開発段階の基本的な問題として,先行投資に見合うリターンを得られるのかが不透明でビジネスモデルが立てにくいとの声はよく聞きます。
佐竹 おっしゃるとおりです。特に治療用アプリの場合,保険収載された製品がまだ1例しかないために,業界の展望を予測しづらいと言えます。今後どの程度市場に受け入れられていくかが,SaMDの未来を決めていくはずです。
黒田 診療報酬における治療用アプリの収載方法で考えられる形としては,睡眠時無呼吸症候群に対し在宅で実施される持続陽圧呼吸療法(CPAP)の遠隔モニタリング加算に似た枠組みとなるでしょうか。
佐竹 ええ。今後さらにラインナップが増え,医薬品と同様に治療の選択肢の一つとして定着すると,製品の価値はさらに上がるでしょう。こうした未来になれば,新規参入の企業の不安も払拭できるはずです。
SaMDとnon-SaMDの違い
田中 次に議論したいのが「薬事・審査フェーズ」における課題です。冒頭に紹介したSaMDの定義では,「どのような医療機器がSaMDに該当するかがわかりにくい」との声がいまだ根強いです。上市後に販売停止となった製品もあると聞いています。
黒田 われわれがソフトウエアの医療機器該当性判断を行うサービスとしてKAHSI(Kyoto Advanced Health Care Software Initiative)プロジェクト5)を立ち上げたきっかけが,まさにその問題です。SaMDに該当するか否かは,治療方針等の決定への寄与の度合いと,リスクの蓋然性を考慮して決定付けられる2)とされていますが,その判定は必ずしも簡単ではありません。
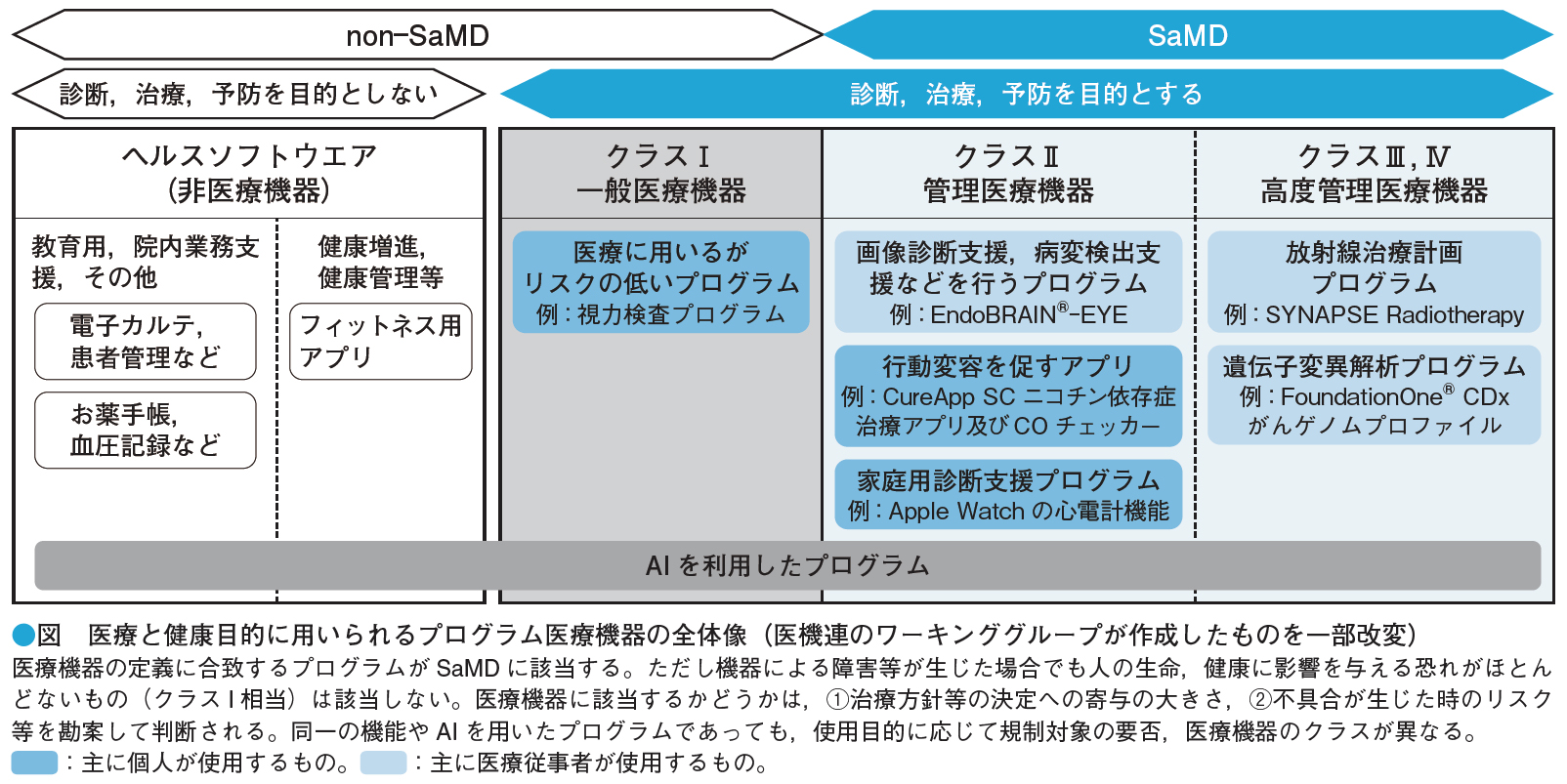
田中 医機連のワーキンググループ内で全体像を俯瞰できるよう本領域を整理しました(図)。図の左側にある電子カルテや患者管理のための電子ツールなどは,診断や治療方針に影響しないため医療機器には該当しません。また,診断・治療・予防目的で使用されている医療機器であっても,不具合が生じた場合に生命および健康へ与えるリスクが極めて低いとされるクラスIに相当する製品は,薬機法に基づく規制を受けない取り扱いとなっており2),実際にSaMDとして扱われる製品はクラスII以上です。
ただし,クラスの判定が難し...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

黒田 知宏(くろだ・ともひろ)氏 京都大学医学部附属病院 医療情報企画部長・教授
1994年京大工学部情報工学科卒。博士(工学)。2001年京大病院講師,03年同院医療情報部副部長(兼任)。07年阪大大学院基礎工学研究科准教授,09年京大病院准教授,13年より現職。医療ソフトウエアの事業化に向けたインキュベーターとして21年にKAHSIプロジェクトを立ち上げるなど,コンピュータ・サイエンティストの立場からSaMDの領域に携わる。

佐竹 晃太(さたけ・こうた)氏 株式会社CureApp 代表取締役社長/医師
2007年慶大医学部卒業後,日赤医療センターなどで呼吸器内科医として勤務する。日本遠隔医療学会理事,日本禁煙学会評議員。12年より中欧国際工商学院,米ジョンズ・ホプキンス大公衆衛生大学院に留学。治療用アプリとしてFDAから初めて承認を得たBlueStar(WellDoc社)に関心を抱き,14年に帰国後,株式会社CureAppを創業する。現在はアカデミアや製薬企業等と連携しながら,幅広い疾患を対象に治療アプリの開発・研究を行う。

田中 志穂(たなか・しほ)氏 一般社団法人日本医療機器産業連合会 法制委員会委員長
2018年にジョンソン・エンド・ジョンソン株式会社メディカルカンパニーへ入社。前職より医療機器業界にて薬事,臨床,QMS関係の業務に従事。医療機器の業界団体である一般社団法人日本医療機器テクノロジー協会(MTJAPAN)経由で21年7月に医機連内に立ち上げられたプログラム医療機器の規制対応ワーキンググループに同社の代表として参加し,主査を務める。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
医学界新聞プラス
[第10回]外科の基本術式を押さえよう――腹腔鏡下胆嚢摘出術(ラパコレ)編
外科研修のトリセツ連載 2025.03.24
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。