がん悪液質対策の現在地
寄稿 内藤 立暁
2021.05.24 週刊医学界新聞(通常号):第3421号より
がん悪液質対策がなぜ求められているのか
がん悪液質は進行がんを有する患者で高頻度にみられる,体重減少と食欲不振を主徴とする症候群である1)。慢性炎症,インスリン抵抗性,骨格筋合成・分解の不均衡などの代謝異常を背景とする機能的疾患であり,病理検査や画像検査ではその病因を肉眼的に確認できない。がん悪液質は進行性の「意図しない体重減少」の程度で診断され,体格の大きさや骨格筋減少の有無も加味される(図)2)。
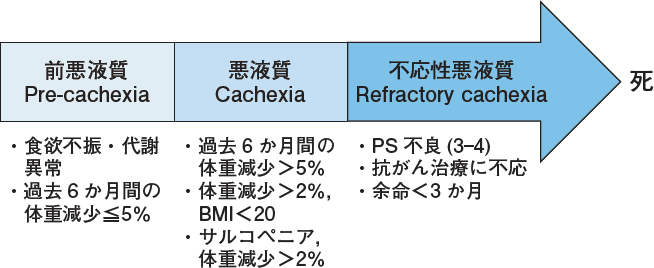
がん悪液質は主に進行性の「意図しない体重減少」の程度によって診断され,体格の大きさや骨格筋減少の有無も加味される。
がん悪液質は,強力な負の予後因子であると同時に,がん治療への耐容能の低下と身体機能障害に関連し,QOLを損なう。また食習慣の変化や高度の痩せは,患者と家族の心理的苦痛を生む。全身状態が不良となる不応性悪液質のステージに至る前に早期に診断し,栄養療法を含めた集学的治療を行うことが重要と考えられているが,標準治療は確立されていないため,現場では対症療法に終始している。日進月歩のがん医療の中で,いまだ治療法開発の進んでいないアンメットニーズの高い領域と言える。
正しい診断基準を知っていますか?
がん悪液質の治療法開発の遅れは,医療者だけでなく患者の関心や理解の低さにも直結している。2020年にわが国で行われたがん悪液質に関するWebアンケート調査では,過去1年間にがん治療経験のある患者538人,家族517人,そして肺・消化器がんの治療経験のある医療従事者1000人が調査に参加した3)。結果,がん悪液質という言葉を知る患者・家族はわずか1割であり,また約半数の患者は治療中に生じた食欲不振や体重減少について,医師や看護師に報告していなかった。対する医療従事者は,8~9割ががん悪液質という言葉を知っていたが,正しい診断基準(図)を知っていたのはわずか3割であり,多くは「終末期で生じる不可避な状態」と認識していたことも明らかとなった。医療従事者の認識の低さは,欧米でも報告されている4)。
多くのがん専門医療施設では,がん悪液質診療の鍵となる管理栄養士や理学療法士の常勤枠が一般病院と比して少ない。しかも管理栄養士や理学療法士のマンパワーの多くは周術期の栄養・運動介入に投入されるため,内科系のがん悪液質のスクリーニング,栄養療法,運動療法は手薄になる。また医師や看護師による患者教育の方法は確立されておらず,ほとんど実施されていない。がん悪液質の診療が普及しない背景には,前述した医療者のがん悪液質への理解不足がある。さらにがん悪液質に特化した診療報酬の加算がなく,病院経営者の理解を得られないことも,その大きな要因となっている。
標準治療確立への期待
1950年代からさまざまな栄養療法の他,コルチコステロイド,プロゲステロン製剤,アンドロゲン誘導体,NSAIDs,サリドマイド,カ...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。

内藤 立暁(ないとう・たてあき)氏 静岡県立静岡がんセンター呼吸器内科 医長
1997年浜松医大卒。2008年より現職。20年より国際がんサポーティブケア学会(MASCC)のNutrition & Cachexia部会の副議長を務める。AMEDプロジェクト,がん悪液質に対する栄養・運動療法(NEXTAC)の臨床研究を主導する。
いま話題の記事
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
-
対談・座談会 2020.02.17
-
医学界新聞プラス
[第11回]外科の基本術式を押さえよう――鼠径ヘルニア手術編
外科研修のトリセツ連載 2025.04.07
-
VExUS:輸液耐性が注目される今だからこそ一歩先のPOCUSを
寄稿 2025.05.13
-
インタビュー 2026.02.10
最新の記事
-
波形から次の一手を導き出す
多職種をつなぐ共通言語としての心電図対談・座談会 2026.02.10
-
健康危機に対応できる保健人材養成
COVID-19と大規模災害の経験を教育にどう生かすか対談・座談会 2026.02.10
-
対談・座談会 2026.02.10
-
取材記事 2026.02.10
-
インタビュー 2026.02.10
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
