バリアの破綻(森信好)
連載
2016.08.22
目からウロコ!
4つのカテゴリーで考えるがんと感染症
がんそのものや治療の過程で,がん患者はあらゆる感染症のリスクにさらされる。がん患者特有の感染症の問題も多い――。そんな難しいと思われがちな「がんと感染症」。その関係性をすっきりと理解するための思考法を,わかりやすく解説します。
[第3回]バリアの破綻
森 信好(聖路加国際病院内科・感染症科医幹)
(前回からつづく)
これまで2回(第3179号,第3183号)にわたり,がんと感染症の関係について紹介してきました。その中で,4つのカテゴリー(バリア,好中球,液性免疫,細胞性免疫)に分けて考え,どの免疫の壁が崩れるとどのような感染微生物の危険にさらされるかを説明してきました。
今回は,一つ目の免疫である「バリア」が破綻した場合の感染症について,より具体的に解説していきたいと思います。バリアとは皮膚や消化管・呼吸器・泌尿器などの粘膜による防御システムのことでしたね。がんそのものや,手術,放射線療法,化学療法,カテーテル挿入などの治療によってそのバリアが破綻すると,本来は自分の体表面や管腔内にいる微生物が体内に侵入し,感染を引き起こします。
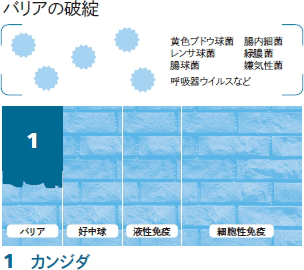
なお,化学療法を行った際には,「バリア」と同時に「好中球」の壁が崩れることにもなります。
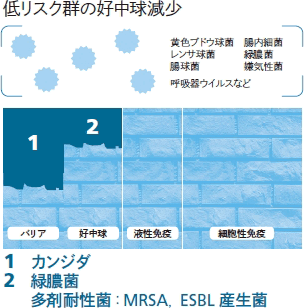
今回はロジックを単純化するために,固形腫瘍の症例からバリアの破綻だけが起きる症例を提示しましょう。
症例1
47歳女性。乳がんに対して両側乳房全摘出術およびエキスパンダーによる乳房再建術施行。術後7日目より38℃の発熱が出現。また左乳房内側に発赤,熱感,疼痛,腫脹あり。意識清明,頭頸部,胸部聴診,背部,腹部,四肢に明らかな異常なし。
超音波検査にて左エキスパンダー周囲に液体貯留があり穿刺液からメチシリン感受性黄色ブドウ球菌(Methicillin-sensitive Staphylococcus aureus;MSSA)が検出された。なお,血液培養は陰性であった。
症例1は,乳房全摘出術後の創部感染症とエキスパンダー感染です。手術で皮膚バリアが破綻し,皮膚の常在菌や手術中操作により入り込んだ細菌が感染を起こしているわけです。エキスパンダーなどの人工物による感染は,人工物の表面にバイオフィルムという細菌の塊が作られるため,抗菌薬治療がしばしば難渋します。そのような場合の治療としては人工物の抜去が基本です。ただし,どうしても抜去できない場合には,バイオフィルム透過性の良い抗菌薬を選択して治療することもあります。
症例2
62歳男性。前立腺がんの疑いに対して前立腺生検を施行。術前にシプロフロキサシンの予防投与を受けていた。同日夜に悪寒を伴う38.6℃の発熱および血圧低下あり。排尿時痛,排尿困難感が増悪している。意識レベルJCS I-2,頭頸部,胸腹部,背部,四肢に明らかな異常なし。血液培養および尿培養よりキノロン耐性の大腸菌が検出された。
症例2は前立腺生検後の急性前立腺炎および敗血症だとわかりますね。直腸からアプローチするため,腸管粘膜および前立腺被膜のバリアが破綻して,腸内に常在する大腸菌が感染を引き起こしています。報告によりまちまちですが,前立腺生検後の尿路感染症は5%程度1)とされています。かつてはキノロン系抗菌薬による予防投与が行われていましたが,症例2のようにキノロン耐性の大腸菌による感染症が増えている2)ので注意が必要です。
カテーテル関連血流感染症の診断方法
ところで,がん患者にはしばしば中心静脈カテーテルが挿入されます。消化管が使用できなかったり,あるいは急性白血病などで寛解導入療法を行ったり,造血幹細胞移植を実施し...
この記事はログインすると全文を読むことができます。
医学書院IDをお持ちでない方は医学書院IDを取得(無料)ください。
いま話題の記事
-
医学界新聞プラス
[第2回]アセトアミノフェン経口製剤(カロナールⓇ)は 空腹時に服薬することが可能か?
『医薬品情報のひきだし』より連載 2022.08.05
-
2025.12.26
-
医学界新聞プラス
[第1回]心エコーレポートの見方をざっくり教えてください
『循環器病棟の業務が全然わからないので、うし先生に聞いてみた。』より連載 2024.04.26
-
対談・座談会 2025.12.09
-
医学界新聞プラス
[第4回]喉の痛みに効く(感じがしやすい)! 桔梗湯を活用した簡単漢方うがい術
<<ジェネラリストBOOKS>>『診療ハック——知って得する臨床スキル 125』より連載 2025.04.24
最新の記事
-
2025.12.26
-
厳しさや大量の課題は本当に必要か?
教育現場の「当たり前」を問い直す対談・座談会 2025.12.09
-
対談・座談会 2025.12.09
-
対談・座談会 2025.12.09
-
インタビュー 2025.12.09
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
