連載
脳腫瘍
発生要因から遺伝子治療まで(8)
脳腫瘍の遺伝子治療-現状と問題点
吉田 純(名古屋大学教授・脳神経外科)はじめに
1992年に,NIH(National Institutes of Health:米国立衛生研究所)のOldfieldらによって,悪性脳腫瘍に対する最初の遺伝子治療が試みられて以来(図1),NIHのrecombinant DNA advisory committee(RAC)に提出された脳腫瘍に対する遺伝子治療のプロトコールの総数は11にのぼる(表1)。そのうちの7本はレトロウイルスベクターを用いてherpes simplex virus-thymidine kinase(HSV-TK)遺伝子を腫瘍細胞に導入し,ganciclovir(GCV)の細胞毒性に対する選択的な感受性を持たせようとしたものである。また,同じHSV-TK遺伝子をアデノウイルスに組み込んだもの,さらに最近では,サイトカイン遺伝子を自己の脳腫瘍細胞に体外で導入(ex vivo遺伝子導入),放射線処理で増殖能を停止させたのち,患者の皮下に接種して腫瘍特異的な免疫能の誘導を図る,いわゆる腫瘍ワクチンと呼ばれる概念に基づくものも現れてきた。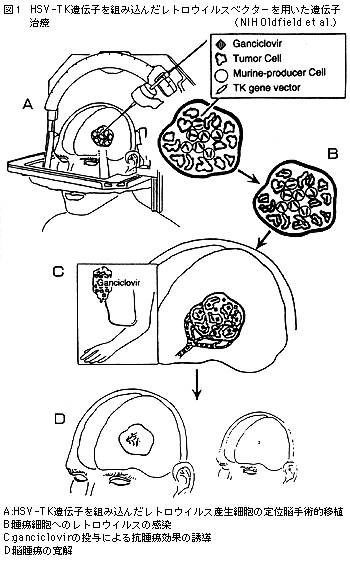
提出されたプロトコールのうちRAC・food and drug administration(FDA)両者の承認を得て治験を開始したのは,4施設5プロトコールのみであり,その成績も未だ公式に発表されるには至っていない。こうした段階ではあるが,本稿では現在までに治験の開始されたアプローチの概念を紹介し,同時にその問題点を踏まえながら将来への展望を試みたい。
| プロトコール(研究者,研究機関) | 最終認可 | 第1回治療 |
|---|---|---|
| (1)Gene therapy for treatment of brain tumors using intra‐tumoral transduction with thymidine kinase gene and intravenous ganciclovir(E.H.Oldfield,NIH) | 92年8月14日 | 92年12月7日 |
| (2)Gene therapy for the treatment of malignant brain tumors with in vivo tumor transduction with the herpes simplex thymidine kinase gene/ganciclovir system(K.Culver,Iowa Methodist Medical Center) | 93年4月16日 | 93年7月13日 |
| (3)Gene therapy for the treatment of recurrent pediatric malignant astrocytomas with in vivo tumor transduction with the herpes simplex thymidine kinase gene(C.Raffel,Childrens Hospital Los Angels) | 93年9月3日 | 未定 |
| (4)Gene therapy for human brain tumors using episome‐based antisense cDNA transcription of insulin‐like growth factor 1 (J.Ilan,Case Western Reserve) | 93年12月2日 | 94年3月 |
| (5)Gene therapy for recurrent pediatric brain tumors (L.E.Kun,St.Jude Children's Research Hospital and NIH ) | 93年10月7日 | 未定 |
| (6)Intrathecal gene therapy for the treatment of leptomeningial carcinomas(E.H.Oldfield,NIH) | 94年1月20日 | 未定 |
| (7)Injection of glioblastoma patients with tumor cells genetically modified to secrete interleukin‐2 (R.Sobol,San Diego Regional Cancer Center) | 94年7月12日 | 未定 |
| (8)Treatment of advanced CNS malignancies with recombinant adenovirus H5.020 RSVTK (S.L.Eck,Univ. of Pennsilvania Medical Center) | 未定 | |
| (9)Phase I study of adenoviral vector delivery of the HSV‐TK gene and the intravenous administration of ganciclovir in adults with malignant tumor of the central nervous system (R.Grossman,Baylor College of Medicine) | 未定 | |
| (10)Stereotaxic injection of herpes simplex thymidine kinase vector producer cells and intravenous ganciclovir for the treatment of recurrent malignant glioma(M.Fetell,Colombia Presbyterian Medical Center) | 95年2月10日 | 95年3月1日 |
| (11)A phase I study of IL‐4 genemodified autologous tumor to elicit an immune response (M.Bozik,Univ. of Pittsburgh Cancer Institute) | 未定 |
HSV-TK遺伝子をコードするレトロウイルスベクターを用いる方法
成人の脳組織は分化を終えた非分裂細胞から成る組織であり,一方腫瘍細胞は増殖能を持っている。レトロウイルスは分裂増殖中の細胞に限って感染するという性質があるため,脳内で腫瘍細胞に選択的に遺伝子導入を行なうベクターとして最適と考えられた。また,HSV-TKはdeoxyguanylic acidの類似体であるganciclovir(GCV)を特異的にリン酸化して細胞のDNAポリメラーゼによって複製中の細胞染色体に取り込ませ,複製を阻害する。初期の実験ではレトロウイルスを含む上清自体を脳腫瘍内に注入していたが,非常に導入効率が低かった。この理由としてはレトロウイルスベクターがin vivo では2-4時間で失活してしまい,その間に増殖期にある細胞の割合は低いことが考えられた。そこでこれ以降はマウスの線維芽細胞由来のレトロウイルスベクターのproducing cellsを直接腫瘍内に注入し持続的に高い力価でベクターを腫瘍局所に分布させることが行なわれ,感染効率を高めることが可能になった。しかし,依然100%の腫瘍細胞に感染させることは不可能であるにもかかわらず,10-70%の細胞が遺伝子導入されていれば,実際にはほぼ完全に腫瘍を消退せしめうることが現象として見出された。この現象はbystander effectと呼ばれて様々なメカニズムの関与が示唆されている。in vitroでも起きる機序として,HSV-TK導入細胞でリン酸化されたGCVがgap junctionによって非感染細胞に運搬されること,またin vivo では腫瘍内の新生血管細胞に導入されたHSV-TK遺伝子が増殖しつつある血管を破壊し微少な血栓を形成して腫瘍細胞への血流を妨げること,またHSV-TK遺伝子とGCVによって起きた殺傷された腫瘍細胞が,何らかの機序で宿主の腫瘍に対する免疫を賦活することも諸々の文献から示されている。
このようなデータを背景に臨床治験が開始された。マウス線維芽細胞由来のレトロウイルスベクター産生細胞が定位脳手術的に腫瘍内に注入され,数日後からGCVの投与が開始された。異種の細胞に対する過剰な免疫拒絶反応および脳浮腫を抑制するためにステロイドも併用された。
現在までのところ,一部の症例で有効例が報告されているが,一方で依然遺伝子導入の効率が予想ほど高くないこともあげられている。ヒトの腫瘍では動物の腫瘍モデルに比して休止期の腫瘍細胞の割合が高いこと,動物実験では必要なかった免疫抑制の処置により,抗腫瘍免疫の果たす役割が弱められていることなどが問題といえよう。今後はベクター産生細胞を用いずに,ベクター濃縮法の改良により,できるだけ力価を高めたレトロウイルスベクターそのものを注入する方法もとられていくと思われる。またそのような工夫がなされたとしても,依然としてこのアプローチはベクター注入の局所療法であることには変わりがない。つまり,浸潤し播種する悪性腫瘍としての脳腫瘍に対する根本治療となり得るかについては未だ疑問が残る。
その他のベクターでHSV-TK遺伝子を運搬する方法
Baylor CollegeのGrossmanらは,HSV-TKをコードする組み換えアデノウイルスを定位脳手術的に局所注入することにより腫瘍細胞に遺伝子導入する方法のプロトコールを提出した。アデノウイルスは感染効率が高くまた非分裂細胞に対しても感染する。発現は一過性であるが,これはむしろ正常組織への長期の影響を考えると望ましいかもしれない。またHSV-TK遺伝子を用いる限り,理論的にDNA合成期にある細胞以外にはGCVの毒性は出ないはずなので,非分裂細胞に感染する性質も大きな危険因子にはならないはずである。ただし,組み換えアデノウイルスベクターはウイルス由来の遺伝子の発現もあり,依然ベクター自体の強い免疫原性が取りざたされている。筆者らの研究室では米国企業との共同研究により,やはりHSV-TKをコードする力価の高い組み換えアデノ随伴ウイルス(adeno associated virus:AAV)ベクターを用いて治療モデルを作成し,その有効性を明らかにした。AAVベクターは野生型ウイルスにも病原性がなく,物理化学的にも非常に安定であることなどから,将来性があると思われる。
サイトカイン遺伝子を用いた免疫遺伝子治療
近年種々のサイトカイン(また接着分子やco-stimulatory molecule)の遺伝子をエフェクター細胞(腫瘍内浸潤リンパ球:tumor-infiltrating lymphocyte,TILやlymphokine activated killer, LAK)あるいはターゲット細胞(腫瘍細胞)に導入,発現させて,それぞれ腫瘍攻撃性の免疫担当細胞の効力をさらに高めたり,腫瘍細胞自身の免疫原性を高め,腫瘍特異的な免疫を賦活化するという試みが進められてきた。後者のいわゆる“腫瘍ワクチン”では,つまり腫瘍抗原と高濃度のサイトカインが生体の局所にて限局して集積した状況を作り出すことによって,効率よく免疫を誘導しようとする。サイトカインの全身投与による補助療法に関しては,治療効果の得られる濃度では全身に対する副作用も強いという問題点もあったが,遺伝子導入により局所的にサイトカインを発現させる場合は,本来のパラクライン的に作用する生理的なサイトカインの発現に近く,副作用も少ない可能性が期待される。
また中枢神経にはdendritic cellなどの強力な抗原提示細胞が分布しないなど,脳腫瘍は原発巣,つまり脳内にあってはその抗原を免疫系に提示するには不利な環境にあるが,皮下組織にて腫瘍抗原を全身の免疫系に暴露することにより,この点が克服されると期待されている。
San Diego Regional Cancer CenterのSobolらは,患者自身の神経膠腫細胞にインターロイキン-2(IL-2)の遺伝子をレトロウイルスベクターを用いて導入し,放射線照射後腫瘍ワクチンとして患者に再び接種するプロトコールを提出,RACの承認を受けた。出版されている1例の報告によれば,他の治療法に反応しなかった患者に対し皮下に10回のワクチン接種を行なったところ,4か月後にMRI上有意な腫瘍の退縮を見,末梢血からは抗腫瘍CD8陽性細胞障害性T細胞の存在が認められた。
University of PittsburghのBozikらもインターロイキン-4(IL-4)遺伝子導入自己腫瘍細胞によるプロトコールを提出した。これらの免疫遺伝子治療は,宿主の腫瘍に対する監視機構を高めようとしている点で,浸潤や播種に対しても有効である可能性がある。しかし一方で,ヒトの悪性脳腫瘍の細胞自身が一般に元来どれほど免疫原性があるのか,という疑問が依然残る。例えばMHCクラス1抗原がサイトカインによりup-regulateされたとしても,その上に提示されるべきいわゆる腫瘍抗原ペプチドは,悪性神経膠腫では一部メッセンジャーRNAでの報告のみで,蛋白あるいはペプチドレベルでは同定されていない。
Case WesternのIlanらは,insulin-like growth factor(IGF)‐1に対するアンチセンスを腫瘍に導入すると,IGF-1の発現が抑制された腫瘍は造腫瘍性を失うばかりかin vivo では抗腫瘍免疫が誘導されると報告し,RACにてプロトコールの承認を受けたが,これも腫瘍ワクチンの1つの形である。一方で,腫瘍ワクチン以外にもサイトカイン遺伝子を用いた免疫遺伝子治療が数多く考案されている。現在われわれもサイトカイン遺伝子,特にインターフェロン-βを用いた遺伝子療法の開発に努めており,その臨床研究のための安全性や効果を検討している。
われわれのストラテジーはインターフェロン-β遺伝子をカチオニックリポソームに包埋し,腫瘍局所に注入,またはオンマヤ貯留槽を介して投与するものである。この抗腫瘍効果についてはヒトグリオーマ細胞をヌードマウス脳内に移植して作られる脳腫瘍モデルを用いて検討している。脳腫瘍モデルでは100%脳内腫瘍が形成され,すべてのマウスが60日以内に腫瘍死する。
この動物モデルを用いてヒトインターフェロン-β包埋リポソームを腫瘍細胞の脳内移植と同時あるいは24時間後,3日後,7日後,9日後に腫瘍増殖部位に隔日に計6回局注した。その結果,7日以内に治療を開始すれば腫瘍発生を全例完全に抑制することが可能であり,また移植後9日目より治療を開始しても腫瘍発生率を有意に減少させることができた。
また治療マウスの脳内を免疫染色にて観察するとasialo-GMI陽性のnatural killer(NK)細胞の著明な浸潤を認めたことより,本治療の抗腫瘍効果には内因性インターフェロン-βの直接的効果の他,宿主の免疫応答反応が強く関与していることが示唆された。さらに,腫瘍壊死因子(TNF-α)遺伝子をヒトグリオーマ細胞に導入すると,多くの細胞にアポトーシスを誘導する抗Fas抗体に対する感受性が高まったり,細胞表面に細胞接着因子の1つであるICAM-1の発現が誘導され,宿主の免疫が惹起されることが証明されている。
今後期待される脳腫瘍遺伝子治療のアプローチ
未だ動物実験段階ではあるが今後の動向に注目すべきアプローチを紹介しておきたい。1つは自己複製可能なヘルペスウイルスベクターによるもので,Georgetown UniversityのMartuzaらをはじめいくつかの施設で研究されている。もともと神経系の細胞に親和性および毒性を持つヘルペスウイルスを増殖細胞においてのみ複製可能な形に組み換えることにより安全性も高いと期待されるベクターを開発している。もう1点はやはりサイトカインを用いた免疫遺伝子治療であるが,今年度に入ってからも注目すべき新しい研究成果が報告されている。
先に紹介したSobolらのグループは,transforming growth factor-β(TGF-β)に対するアンチセンスベクターを導入したラット9L細胞株を用いて,IL-2を上回る腫瘍ワクチン効果を見出した。TGF-βはヒト神経膠腫においてもしばしば強く発現している免疫抑制性のサイトカインであり,腫瘍が宿主の免疫監視機構を逃れて増殖するメカニズムに関与していると報告されてきた。またHamadaらのグループは,granulocyte-macrophage colony-stimulating factor(GM-CSF)を中心に従来から様々なサイトカインの腫瘍ワクチンにおける効果を検討してきたが,比較的治療効果を見出すのが困難であった脳内腫瘍の系においてもGM-CSFとIL-4を組み合わせるとかなりの効果が見られると報告。
これらの報告は,腫瘍ワクチンという基本アイデアの上に最新の免疫学的知見をフィードバックさせ,工夫を積み重ねてよりよい戦略を発見していくという研究が,がん治療研究の1つのメインストリートとして定着してきたことを物語る。
