1998年ノーベル医学・生理学賞解説
NO発見と生命科学へのインパクト
平田結喜緒 東京医科歯科大助教授・第2内科
 1998年のノーベル医学・生理学賞はR. Furchgott米ニューヨーク州立大名誉教授,L. Ignarro米カリフォルニア大ロサンゼルス校教授,F. Murad米テキサス大教授の薬理学者3氏に授与されることが発表された。その授賞理由は「循環器系における信号伝達分子としての一酸化窒素(NO)の発見」である。1996年には米国のラスカー賞をFurchgott,Murad両博士が授与されていたことから,ノーベル賞の決定も間近であろうと予想されていたが,NOに関する研究が今や生命科学の分野で爆発的な勢いで発展している現状でその発見者に授与されるのは当然と言えよう。
1998年のノーベル医学・生理学賞はR. Furchgott米ニューヨーク州立大名誉教授,L. Ignarro米カリフォルニア大ロサンゼルス校教授,F. Murad米テキサス大教授の薬理学者3氏に授与されることが発表された。その授賞理由は「循環器系における信号伝達分子としての一酸化窒素(NO)の発見」である。1996年には米国のラスカー賞をFurchgott,Murad両博士が授与されていたことから,ノーベル賞の決定も間近であろうと予想されていたが,NOに関する研究が今や生命科学の分野で爆発的な勢いで発展している現状でその発見者に授与されるのは当然と言えよう。
本稿ではNOの発見に至る経過,歴史的背景,および今後の展望について述べてみたい。
NOの発見
Furchgott博士は摘出血管を用いて薬物の弛緩反応を研究していたが,古くからアセチルコリンを生体に投与すると血管拡張作用が生じるのに,摘出血管に投与すると逆に収縮作用が観察されることに疑問を抱いていた。このようなアセチルコリンの収縮作用は従来の血管のラセン標本を用いる場合にみられたが,新しく輪状標本を用いると弛緩作用が観察されるようになった。彼はイソプロテレノールの弛緩作用をみる目的でテクニシャンに血管標本を先にノルエピネフィリンで収縮を起こした後,十分洗浄して次にアセチルコリンの収縮反応を観察するというプロトコールを指示した。ところがアセチルコリンでは弛緩作用が起こってしまうとテクニシャンが彼の元に報告に来たが,よく聞いてみるとノルエピネフィリンの収縮後,洗浄操作を怠っていたことが判明した。すなわちノルエピネフィリンの前収縮の後にアセチルコリンを投与すると常に弛緩反応が観察され,しかも標本作製の際に内膜を傷つけやすいラセン標本より輪状標本で多くみられることから,この弛緩反応は内膜の存在が重要ではないかと推測した。そこで内膜が無傷の標本と擦過した標本を用いて比較してみると,アセチルコリンは前者では弛緩反応,後者では収縮反応がみられた。彼の予想は見事に的中したわけで,その間のいきさつは彼自身の手による逸話に詳しい(Circulaton 87〔SupplV〕:V-3,1993)。彼はこの物質を新たに内皮由来弛緩因子(endothelium-derived relaxing factor:EDRF)と命名した(Nature 288:373,1980)。EDRFの発見はまさにテクニシャンのミスが発端とはいえ,やはり彼の科学者としての鋭い洞察力と実験結果をアーチファクトとして片づけず,その原因を執拗に追求した研究者としての探求心によるものと言えよう。一方,Murad博士(当時バージニア大)はニトログリセリンを代表とする硝酸薬の血管弛緩作用を研究する中で,硝酸薬がNOを放出し血管平滑筋の可溶性グアニル酸シクラーゼを活性化してサイクリックGMP(cGMP)を生成することによって弛緩反応が起こることをすでに1977年に見出していた。しかしその生理的意義が不明なため,あまり注目を浴びなかった。19世紀から抗狭心症薬として広く用いられていたニトログリセリンの作用機序は長く不明であったが,その突破口になったのは彼の発見によるところが大きい。
EDRFはNO
EDRFは不安定な物質で半減期が数秒ときわめて短いため,その化学的同定は困難を極めていた。しかし,Furchgott博士とIgnarro博士らの研究グループは全く独立して1986年,米国ロチェスターで行なわれた国際学会でEDRFとNOの薬理学的相同性から両者は同一の物質であると提唱し,1988年に単行本「Mechanism of Vasodilatation」(P.M. Vanhoutte編,Raven Press)として刊行された。一方,英国Welcome研究所のS. Moncada博士(現ロンドン大教授)は,化学発光法を用いてEDRFの本体がNOであること(Nature 327:524,1987)を,翌年にはNOがl-アルギニンから生成されること(Nature333:664,1988)を発表した(表)。そしてIgnarro博士もEDRFがNOであることを1987年に発表しているが(Proc Natl Acad Sci 84:9265,1987),3名のノーベル賞受賞者の中にMoncada博士が選ばれなかったことに対する批判が英国の科学者の間から湧き上がっている(Nature 395:625,1998)。ノーベル賞授賞者の選考には常に最初の発見者が誰であるかが問われるが,1賞あたり3名以内の制限があるため,受賞をめざす研究者間の競争が熾烈になるのは当然であろう。この問題は本稿の主旨ではないので割愛させていただくが,この辺りの話題は『ノーベル賞ゲーム』(丸山工作編,岩波書店,1989)に詳しい。
表 NO研究の歴史
|
NOを作る酵素
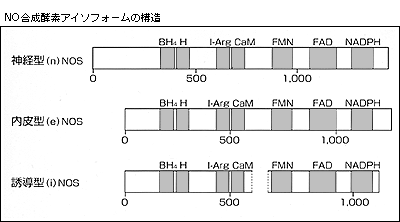
さてNOはl-アルギニン(Arg)からNO合成酵素(NO synthase:NOS)によって生成されるが,神経,マクロファージ,内皮では異なるNOSアイソフォームの存在が80年代末に明らかとなり,その生化学的同定が精力的に行なわれた。90年代初めには分子生物学的手技を導入して,まず神経型NOS(nNOS)が神経生理学者のSynderら(ジョンホプキンス大,1991年),翌年には内皮型NOS(eNOS)が循環器学者のMichelら(ハーバード大)やAlexanderら(エモリー大),誘導型NOS(iNOS)が免疫学者のNathanら(コーネル大)のグループによって一挙にクローニングされ,その構造が解明された(図)。3種類のNOSアイソフォームの基本構造は同じで,C末端にはNADPHやフラビン(FAD,FMN)の結合部位を持ちシトクロームP-450レダクターゼと相同性を示す。中央部にはカルモデュリン(CaM)結合部位を,N末端にはヘム(H),l-Arg,テトラヒドロビオプテリン(BH4)の結合部位を持つ。すなわちNOSはN末端のオギゲナーゼドメインとC末端のレダクターゼドメインを共有する自己完結型酵素といえる。nNOSとeNOSはそれぞれ神経系と内皮に構成的に発現し,刺激因子によって細胞内Ca2+濃度が上昇すると直ちにCaM依存性にNOSが活性化される。Furchgott博士が観察したEDRFは実はアセチルコリンが内皮細胞のムスカリンレセプターを介してeNOSを活性化する結果,l-ArgからNOが生成,放出されたわけである。eNOSは他にもブラジキニン,エンドセリン,セロトニン,ヒスタミンなどのアゴニストやズリ応力によって同様の機序で活性化され,内皮依存性弛緩反応が生じる。一方iNOSは通常発現していないが,エンドトキシンや炎症性サイトカイン(IFN-γ,IL-1,TNF-αなど)が存在するとマクロファージをはじめとして広範な細胞で誘導され,Ca2+非依存性に大量のNOを生成する。
NOの2面性
NOはガス状ラジカル物質であるため容易に細胞間を拡散し,標的分子に作用して多彩な生理活性を示す。その代表的なものが可溶性グアニル酸シクラーゼであり,ヘム基をニトロシル化して活性化するとcGMPが生成され,血管平滑筋弛緩や血小板凝集阻害をもたらす。NOは他にも非ヘム酵素(シスアコニターゼ,complex I,II,リボヌクレオチドレダクターゼなど)に作用してその酵素活性を阻害する。またスーパーオキシド(O2-)と反応してperoxynitrite(ONOO-)やヒドロキシラジカル(OH・)といった毒性の強い酵素ラジカルを生成して細胞毒性を示す。したがってNOは生体にとって有益な作用と有害な作用という全く異なる2面性を持つことになる。このようにNOは従来のホルモン,神経伝達物質,成長因子,サイトカインといったレセプターを介して作用するのとは異なり,直接標的細胞に作用するきわめてユニークなガス状分子種といえる。さらにNOの作用も血管トーヌスの調節(eNOS),神経伝達(nNOS),免疫防御(iNOS)など臓器を超えて広範であるゆえに,その機能をめぐってあらゆる分野の研究者が関心を持ち精力的な研究が繰り広げられている。現在もNO関連論文は全科学論文の約1%を占めているという。1992年にScience誌がNOを“Molecule of the Year”に選んだ由縁である。1993年には発生工学を導入してnNOS欠損マウス,1995年にはiNOSおよびeNOS欠損マウスが樹立されている。nNOS欠損マウスでは幽門狭窄症や易攻撃性,iNOS欠損マウスでは易感染性やエンドトキシンショック抵抗性,eNOS欠損マウスでは高血圧が主な表現型として観察されている。今後これらのNOS欠損動物を用いて,内因性NOの生理的役割と各NOSアイソフォームの役割分担が徐々に解明されてくるものと期待される。
