【対談】 | 家族性パーキンソン病 | Part 2 |
| 水野美邦氏 (順天堂大教授・神経学) | 清水信義氏 (慶應義塾大教授・分子生物学) |
パーキン発見の過程
(2297号よりつづく)
発見の秘密
水野 今回の成果は,清水先生のグループのすばらしいDNAライブラリーと,スタッフとテクニックに負うところが大きいのですが,1つ付け加えると,その手前の段階の連鎖解析が意外に早くできたのは,幸運に恵まれたといっていいと思います。通常,連鎖解析というのは,全染色体をカバーするマイクロサテライトマーカーを使って,1-2年かけてローラー方式で行ないます。またこれまでの研究で,孤発性パーキンソン病の遺伝的素因を解析する過程におけるミトコンドリア障害と活性酸素の役割がわかっていましたが,この両者の接点にある蛋白がマンガンSODです。これはミトコンドリアの中に発現して,活性酸素の代謝に関連しているので,もしかしたらこの遺伝子多型がパーキンソン病の発症に関連しているのではないかと思い,まずマンガンSOD遺伝子多型だけを見つけようとしました。それを私どもの教室の松村晃絵君と松峯宏人君が,パーキンソン病の患者さんのDNAを用いて,マンガンSOD遺伝子のシークエンスをして新しい遺伝子多型を発見しました。それがシグナルペプチドのバリンがアラニンに変わる変異で,確かにパーキンソン病患者さんのほうが変異の頻度が高かったことがわかりました。
そのDNAのサンプルの中に,たまたまこのAR-JPも入っていたのです。教室で経験した1家系は,発症者はすべてアラニンに変異していて,非発症者はアラニンとバリンのヘテロでした。もう1つそのような家系が見つかりましたが,こちらはアラニンではなく,すべてバリンでした。
結果的にいうと,マンガンSODは病気の遺伝子ではありませんでしたが,たくさんの家系の中に,たまたま遺伝子の変異を持ったAR-JPの家系がたった1つだけあったのです。それでマンガンSODの近くに遺伝子があるだろうと想定して,その付近のマイクロサテライトマーカーを使って連鎖を証明しました。教室だけでは家系が小さく,ロッドスコアは1.7ぐらいで,新潟大の辻教授のところへ教室で使ったマーカーを全部送って,11家系ほど分析していただきました。全部併せてロッドスコアを計算すると,非常に高い値になったのです。本当に幸運だったと思いますね。それがないと1年か2年は余計にかかっていたと思います。
そしてもう1つ,広島大学の山村先生が本疾患を1973年に初めて国際誌に発表されましたが,先生はたくさんの患者家系をお持ちでいらして,その中の患者さんの1人がたまたま大きな遺伝子の欠失をホモ接合体で持っていらしたのです。D6S305というマーカーで,とにかくどこにあるかは定かでありませんでしたが,その患者さんでは欠失していました。それで,おそらくこのマーカーが原因遺伝子の中にあるだろうというところから,今度の遺伝子クローニングも始まったのです。
清水 その欠失が第7エキソンそのものだったという,これも驚くべきことでした。
水野 ハンチントン病で初めてマーカーを使って連鎖解析に成功したグループも,8つくらいのマーカーしか使っていなくて,たまたまそのうちの1つに連鎖するものが入っていたというから,それも低い確率ですね。
清水 まずスタートの段階で,患者さんや家系例をたくさん持っておられる臨床家の協力が大事ですね。
|
BACライブラリーとエキソントラッピング
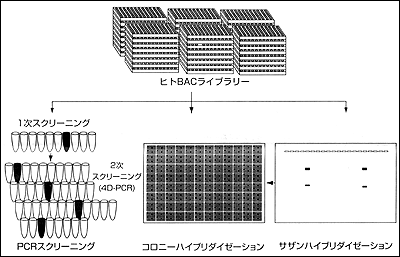
清水 遺伝子をつかまえる時に,私たちのところでは「慶應BAC(Bacterial artificial chromosome)ライブラリー」と呼んでいる,独自に作製したヒトゲノムDNAライブラリーを用いています。BACは大腸菌の中でヒト染色体のDNA断片を増やすことができるベクターです。他にもベクターとしてプラスミド,ラムダファージ,コスミドといろいろありますが,特にBACは150kbぐらいの大きなDNA断片をきわめて安定に操作できます。過去にはYAC(Yeast artificial chromosome)が重宝されましたが,酵母で増やしている間に,ヒトDNA断片がしばしば組み換えを起こしてしまう難点がありました。私たちはこれまでに1000個を超えるBACクローンを解析しましたが,組み換えを起こした例をいまだ経験していません。そういう非常に安定したライブラリーで,すでにヒトゲノム研究には欠かせない基盤となっています。今回も,ただちに20万クローンからなる慶應BACライブラリーの中から対応するヒトDNA断片を含むクローンを取り出す作業を行ないました。BACクローンはだいたい100-150kbぐらいの大きな断片ですので,その中に通常の遺伝子(20-50kb)ならば十分納まってしまうのが普通です。そこで,まず患者さんで最初に見られたマーカーD6S305が乗っているBACクローンを得ようと,PCR法でスクリーニングした結果,対応するクローンが2個得られました。一方,通常の遺伝子は10-20個くらいのエキソンからできているので,これらのBACクローンからエキソントラッピングを行なえば,それぐらいの数のエキソンが得られることを予測したのですが,実際にはエキソンが1個しか存在しなかったのです。すなわち,このエキソンはとてつもなく大きなイントロンに囲まれていることが推定され,遺伝子全体を知るには両隣のBACクローンをもっと分離することが必要となりました。
一方,最初に見つけた1個のエキソンを用いて組織におけるmRNAの発現をノーザンブロット解析した結果,4.5kbのmRNAバンドが脳や骨格筋で確認できました。そこで,胎児脳と骨格筋由来のcDNAライブラリーをスクリーニングし,最終的に,2960塩基という長いcDNA配列が得られました。この塩基配列の中には1395塩基の翻訳領域が含まれ,そこから分子量5万1000の蛋白質,すなわちユビキチンとRINGフィンガードメインを持つパーキンが産生されることが判明しました。
水野 翻訳領域以外の残りの1500塩基は何をしているのですか。
清水 それは上流や下流のいわゆる非翻訳領域(UTR)で蛋白合成の際にリボゾームに結合したり,mRNAの安定性を調節したりと,いろいろな役割が知られています。
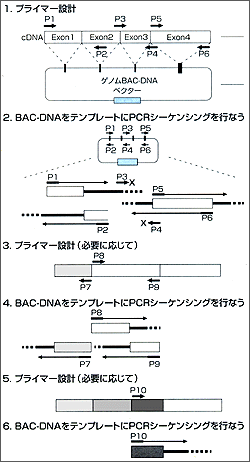
ところで,巨大なパーキン遺伝子のエキソン/イントロン構造(ゲノム構造)の決定について少し述べたいと思います。このために,私たちは慶應BACライブラリーを今度は高密度レプリカフィルターを用いて,全長cDNAをプローブにして,スクリーニングし,最終的に遺伝子全体をカバーするBACクローンを十数個得ました。このようなたくさんのBACが得られたことは遺伝子が巨大であることをあらためて想定させました。その後の解析は,私たちが開発したBACクローンとcDNAの塩基配列とを併用する迅速解析法を用いて行ない,エキソン/イントロン構造と境界領域の塩基配列を短期間に決定することができました。その結果,パーキン遺伝子は12個のエキソンから構成されていることがわかりました。そして,各エキソンを増幅するためのPCRプライマーをデザインして患者DNAにおける変異の検定を行なった結果,主に欠損変異を見出したので,今回のパーキン発見に至ったというわけです。
|
パーキンソン病研究の今後の展開
原因遺伝子発見のその先
――原因遺伝子が発見され,今後すぐに証明すべき点とは何でしょうか。清水 今はまだcDNAの部分がわかっただけで,いわゆる遺伝子のゲノム構造からいえば,エキソンとその境界のところがわかったというところです。実際には500kbを超える巨大な遺伝子で,その発現調節などがわかるようになるためには,このすべての塩基配列を決めることです。これは50万文字以上で書かれているので大変なのですが,私どもの施設はゲノムシークエンシングの基盤センターなので,それを一挙にやってしまおうと考えています。そうすれば,いわゆるプロモーター領域が明らかになりますし,大きなイントロンの中にひょっとしたら別の小さな遺伝子が入っているかも知れないという疑問も解消されると思います。
それから,実際にこの遺伝子が黒質で発現されていることに関して,もう少し詳しい様子を,できれば培養細胞を使って研究したいですね。パーキンの蛋白質自身の作用は,さきほど述べたように,ユビキチンと転写因子という組み合わせなので,これがもし転写因子であれば,それが制御する相手側の遺伝子,下流にある遺伝子をつかまえる必要が出てきます。というように,きわめて基礎的な研究をとりあえずやらなければと思っています。
それから,固体レベルでいえば,この遺伝子は欠損で発症しているので,ノックアウトマウスを作製して病態モデルとして活用することが,基礎研究として次にやらなくてはいけないことですね。
|
パーキンソン病の治療薬開発
――今後の臨床における研究の展開について,お聞かせください。水野 パーキンソン病の治療薬の開発は,神経変性のステップが1つずつわかっていけば,それをどこかで断ち切るような薬を,あるいは神経細胞の遺伝子を,また遺伝子治療も含めてというような研究が可能になってきています。すでにα-synucleinやパーキンの報告がある前から,その方面に製薬会社は相当エネルギーを使っているんですね。それは今,対症治療薬はたくさん存在し競争になっていて,そういうものはこれ以上必要ないのです。今後はやはり病勢の進行を止める薬が必要だと思います。最近,「ニューロプロテクション」という概念が非常に広まってきており,また「ニューロレストレーション」といって,死にかけているニューロンをもう1度再生するという方向にきているのですが,そういう研究に対してパーキンやα-synucleinは,非常に有力な武器になると思いますね。
実際に薬が開発されて使用できるようになるには,まだ10年とか20年とかかると思いますが,少なくとも患者さんには相当な光を与えたと思います。 清水 先生がおっしゃるニューロプロテクション,ニューロレストレーションというのは,パーキンの蛋白と絡めて考えますと,遺伝性の場合は欠損変異ですが,通常の孤発性の場合は変性するのが認められています。これは何らかの遺伝子以外のファクターですから,パーキンが決定的に重要な役割を果たしているとすれば,このパーキン蛋白の変性をいかに抑えるかが,ニューロプロテクションの中身ではないかという気がします。その意味でも,遺伝子変異を早期に発見して長期的な治療を施すという工夫も大切になるでしょう。これまでの患者DNAの解析では,1個あるいは複数個のエキソンにわたる欠失変異だけでなく,点変異も見出されています。したがって,かなり高精度の早期DNA診断ができるようになっています。
遺伝子治療の可能性
水野 もう1つ,この患者家系について言えば,将来,遺伝子診断をして,正常な遺伝子を線条体に導入することによって発症が予防できるかもしれませんね。清水 遺伝子そのものはとてつもなく大きいのですが,cDNAの形ではそれほど大きくはありません。いわゆるミニジーンとして入れられる可能性はあります。
水野 最近はパーキンソン病でも遺伝子治療が結構進められています。まだニューロプロテクションまではいっていませんが,小川松夫先生(自治医大)と永津俊治先生(藤田保衛大)の共同研究で,アデノ随伴ウイルスにドーパミンを作るチロシンハイドロキシレースとドーパデカルボキシレースを組み込み,それを実験的にパーキンソニズムにしたマウスの線条体に入れると,ちゃんとドーパミンを作ることが証明されています。また,対症療法の段階では動物でも遺伝子治療が成功しています。それと同じ手法でこのような原因遺伝子を入れることも可能だと思いますし,ヒトでの安全性を確かめることが大事ですけれど,もしそれが確かめられれば,遺伝子治療も可能になると思います。
清水 今回の成果はあくまでも若い先生たちの熱意というか頑張りがあって生まれたので,若手が頑張ってくれたということに,大いに感謝したいと思います。
水野 同感です。
――本日はありがとうございました。
(おわり)