肝硬変から肝癌へ-分子生物学的側面
DDW-Japan 1998パネルディスカッションより
 「『国民衛生の動向』によれば,わが国の肝硬変の死亡率は1993年度人口10万人当たり男性18.9人,女性8.5人となっている。したがって,実数では男性1万1500人,女性5400人,合計約1万7000人となり,肝硬変単独の死亡率はここ10年間ほぼ変化がない。しかし最近,肝細胞癌による死亡率が増加しており,1993年度の肝細胞癌による死亡は約2万3500人である。肝細胞癌の約80%に肝硬変が合併していることから,肝硬変単独1万7000人を合わせた約3万5800人が肝硬変および肝硬変に合併した肝細胞癌で死亡していることになる」
「『国民衛生の動向』によれば,わが国の肝硬変の死亡率は1993年度人口10万人当たり男性18.9人,女性8.5人となっている。したがって,実数では男性1万1500人,女性5400人,合計約1万7000人となり,肝硬変単独の死亡率はここ10年間ほぼ変化がない。しかし最近,肝細胞癌による死亡率が増加しており,1993年度の肝細胞癌による死亡は約2万3500人である。肝細胞癌の約80%に肝硬変が合併していることから,肝硬変単独1万7000人を合わせた約3万5800人が肝硬変および肝硬変に合併した肝細胞癌で死亡していることになる」
「癌は1つの変異細胞に起因し,その基本的病変の場はDNAにある。したがって,環境中のどのような要因が細胞DNAに異常を引き起こしてヒトの癌を発生させるのかという点と,DNA異常を起こした細胞がどのような機構を経て癌化するのかという2点がヒトの癌を制御するうえで重要である。(中略) 肝細胞癌は他の癌と同様,多段階変化を経て発生,進展することが病理学的に知られている。そこで,ウイルス感染を引き金とし,慢性肝炎,肝硬変を発生母地とする一連の肝細胞の悪性化過程を,分子生物学的に解明することが求められている」(戸田剛太郎・他編『肝臓病学 Clinical Science』および『肝臓病学 Basic Science』〔医学書院刊〕より)。
こうしたわが国の特異な事情を踏まえて,肝臓学会,消化器病学会,消化器外科学会合同企画によるパネルディスカッション「肝硬変から肝癌へ-分子生物学的側面」(司会=東大 小俣政男氏,宮崎医大 坪内博仁氏)では,近年進歩の著しい分子生物学の最新の研究成果を踏まえ,細胞増殖促進因子および細胞増殖抑制因子と受容体,細胞周期,テロメア長とテロメラーゼ活性の観点から,この“古くて新しいテーマ”とも言える「肝硬変から肝癌にいたるメカニズムの解明」が試みられた。
受容体型チロシンキナーゼ
多くの癌遺伝子がチロシンキナーゼ活性を持つことが知られているが,同時に正常な増殖因子受容体の多くがチロシンキナーゼ活性を持ち,細胞内の情報伝達に深く関与している。また,その内の受容体型チロシンキナーゼはその構造からI 型(EGF受容体),II 型(IGF-I:insulin like growth factor=インスリン様増殖因子- I 受容体),III 型(PDGF:platelet-derived growth factor=血小板由来増殖因子受容体),IV 型(FGF:fibroblast growth factor=線維芽細胞増殖因子受容体)および V 型(HGF受容体)の5つに分類される。癌細胞の増殖・分化,さらには接着・浸潤・転移に関して受容体型チロシンキナーゼの受容体シグナル伝達の重要性が着目されており,ヒト癌では多くのチロシンキナーゼ遺伝子の発現異常や変異が報告されている。しかし,肝癌の発生・悪性化進展過程において,どのように受容体チロシンキナーゼ遺伝子発現に特異的変化が生じているのかはまだ明らかではない。
大津留昌氏(長崎大)は,ラット化学肝発癌とヒト肝細胞癌の受容体型チロシンキナーゼの発現の動態を明らかにし,その局在および発癌過程における特異性を検討し,「リガンド-チロシンキナーゼ型受容体シグナルの特異的変化が,癌細胞-間質細胞ネットワークを介して,肝発癌・悪性化進展過程に重要な役割を演じ,さらにこれらの中に肝癌の癌遺伝子候補の存在する可能性がある」と示唆した。
レチノイドX受容体とMAPKカスケード
わが国の肝癌の9割が感染症,すなわちB型およびC型肝炎ウイルス感染を母地として発生し,いわゆる多段階発癌の過程を経ることが明らかになったが,各ステップでどのようなDNA異常がどのような順序で惹起されるのか,という点についてはいまだに不明な点が多い。第2回織田敏次賞を受賞した森脇久隆氏(岐阜大)は,肝発癌過程で出現するRXR(retinoid X receptor:レチノイドX受容体)のプロセッション異常の意義を検討。同氏は,肝硬変から肝癌への発癌過程で,RXRのプロセッシングに異常が導入されることを明らかにし,「癌化(脱分化)にRXRを介したレチノイドの分化制御の異常が関与する可能性が強く示唆される」と報告した。
一方,MAPK(mitogen‐activated protein kinase)カスケードは,広範囲な細胞機能の調節において広義のシグナル伝達の中枢経路の1つとして機能していることが知られている。また,その構成分子は細胞性癌遺伝子によってコードされているため,癌細胞ではその遺伝子異常がMAPKカスケードの恒常的な活性化をもたらし,増殖進展に結びつくことが考えられている。佐々木裕氏(阪大)は,ヒト原発性肝癌におけるMAPKカスケードの活性化とその意義について検討し,「ヒト原発性肝癌では,増殖因子受容体の活性化とそれに伴うMAPKカスケードの活性化が観察され,転写因子,細胞周期関連遺伝子の発現亢進を介して肝癌の増殖進展に関与していることが示唆された」と報告した。
肝硬変から肝癌への進展過程における細胞周期
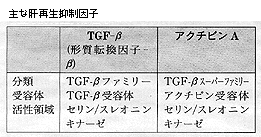
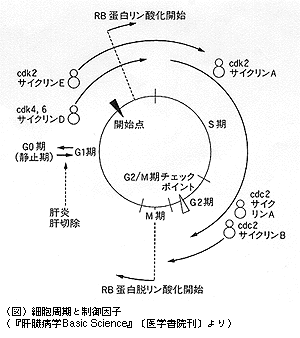
正常な肝臓の実質細胞は分化細胞で,その細胞周期は進行が止まったG0期(静止期)にある。そして,サイクリンとcdk(cyclin‐dependent protein kinase:サイクリン依存性蛋白キナーゼ)によって引き起こされる細胞周期は,染色体DNAが複製されるS期(synthetic period),複製された染色体が紡錘体によって分離した後に細胞質分裂が生ずるM期(mitotic period),M期からS期までのG1期(gap period),およびS期からM期までのG2期からなる。また,細胞周期には細胞周期の進行をチェックして,それを制御するチェックポイントが存在する(下図参照)。長原光氏(ワシントン大・ハワードヒューズ研)は,肝癌細胞のG1期における細胞周期停止機構の解明という視点から検討し,「HepG2細胞がTGF-βおよびHGFという異なるシグナル伝達系を介して,G1期で細胞周期が停止することを見いだし,それが異なる機構によって制御されていることが解明された」と報告した。
長原氏によれば,TGF-βおよびHGFは肝癌に抑制的に作用するが,TGF-βがCAK(cdk activating kinase)に抑制的に作用することによって,G1停止を誘導するものと考えられる。また一方,HGFでは遺伝子産物であるp27の増加をもたらし,これがcdk2サイクリンEと高度に結合していることが明らかになり,両者はそれぞれ異なる機構に基づいている。
また,肝硬変から肝癌への進展過程におけるG1サイクリンに関与する細胞周期関連蛋白質の動態変化を解析した正木勉氏(東大)は,「肝硬変から肝癌への進展過程において,cdk2サイクリンEの活性は上昇し,その要因としてサイクリンE, cdk2の蛋白量の増加以外にcdkインヒビターであるp21の減少と,サイクリンを活性化するフォスファターゼであるcdc25Aの増加を導く情報伝達が存在すると考えられる」と発表した。
テロメア長とテロメラーゼ活性
テロメアは染色体末端に存在し,染色体の安定性を保持するとともに,分裂時計としても機能し,正常体細胞では細胞分裂とともに短縮し,限界まで達すると染色体が不安定になり細胞が死滅することが知られている。一方,テロメラーゼ酵素はテロメアを保持・伸長する(テロメラーゼ活性)ことによって細胞に不死化をもたらし,癌細胞の増殖に重要な役割を担っていると考えられている。熊祖一裕氏(岡山大)は,慢性肝炎,肝硬変,肝細胞癌のテロメア長,テロメラーゼ活性およびテロメラーゼ関連蛋白質の解析を通じて,慢性肝疾患から肝細胞癌に至る過程における細胞分裂状態と不死化について検討した。
熊祖氏によれば,肝細胞癌におけるテロメアの陽性率は高分化型癌,中・低分化型でそれぞれ83%,79%。また,正常肝および非担癌肝組織における陽性率がそれぞれ0%と17%であるのに対して,担癌肝非癌部組織における陽性率は38%とやや高率であった。しかし,非癌組織においては,肝癌組織でみられるテロメラーゼ活性は認められず,このことから,テロメラーゼの強陽性所見は癌への進展に特異的なものと考えられる。
一方,テロメラ長に関して熊祖氏は,正常肝(平均7.1kb),肝硬変(平均6.4kb),肝細胞癌(平均5.2kb)と病期が進むにつれて短縮することを示し,「テロメアが遺伝子の安定性に関係していることと,病期の進行に伴って発癌率が上昇することを結びつける上で興味深い結果であった」と報告。さらに,「テロメラーゼ関連蛋白質として同定されたTP1(Teromerase protein 1)は,安定的RT-PCR法では肝癌のみならず,テロメラーゼ活性が陰性である非癌組織にも認められ,癌化への関連については定量的検討が必要である」と結んだ。

