1997年ノーベル医学・生理学賞解読
Prusiner教授とプリオン研究の歴史
立石 潤 九州大学名誉教授
 1997年度のノーベル医学・生理学賞はカリフォルニア大学サンフランシスコ校のStanley B. Prusiner教授(以下プルシナー,〔敬称略〕)の単独受賞となった。
1997年度のノーベル医学・生理学賞はカリフォルニア大学サンフランシスコ校のStanley B. Prusiner教授(以下プルシナー,〔敬称略〕)の単独受賞となった。
この分野では1976年の同賞がNIHのD.C.Gajdusek博士に授与されており,これはニューギニアのクールーやクロイツフェルト・ヤコブ病(CJD)のチンパンジーへの感染実験の成功に対して与えられた。いずれも患者脳乳剤をチンパンジー脳内に接種後,約2年を経て発病したところから,遅発性ウイルス感染症に分類されたが,病原ウイルスはいまだ発見されていない。
プリオン仮説の提唱
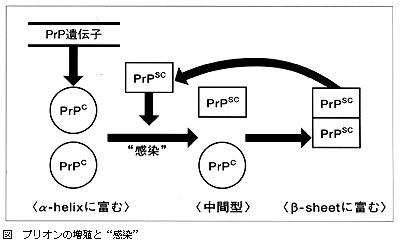
1971年頃からプルシナーは,スクレイピー感染マウスの脾臓をすりつぶし,物理化学的性質の差により分画を分け,各分画の感染症を測定する研究を開始した。遠沈速度と時間を変え,得られた分画をマウスに接種する実験を2年間重ねたが,感染因子は30倍に濃縮したのみであったという。その後,脳内接種後60日前後で発病するスクレイピー感染ハムスター株を得て,感染力価の測定法を改良し,蔗糖濃度勾配遠沈をzonal rotorを用いて行ない,約5,000倍に精製濃縮した大量の感染分画を得ることができた。この下積みの研究に彼は10年を費やしたが,この感染分画を用いることにより,スクレイピー感染因子の研究は飛躍的に進展した。それらの成果を1982年のScience誌に単名でまとめて発表しているが,その内容は今読み直してみてもほとんど訂正の必要な箇所は見当らない。すなわち感染分画はほぼ単一の蛋白質から成り,その収量は感染力価に比例し,プロテアーゼによる消化やDEP,SDS,chaotropic塩,フェノールやウレアなどの処理により不活化されるところから蛋白質が感染因子であり,一方,感染分画に核酸は証明されず,核酸分解酵素や紫外線照射,その他の化学反応によっても感染性は変わらないところから,核酸の存在は否定されるとして,蛋白質のみから成る感染因子“プリオン”を提唱した。その主体をなすプリオン蛋白が作られ,感染因子として増える機序については当時は何もわかっていなかったので,彼はいくつかの仮説を記載している。その1つが核酸の指示なしで蛋白質が作られるというもので,分子生物学の基本命題に反する考え方として各方面からの非難が集中した。
プリオン仮説の実証
プルシナーらが抽出した蛋白分画を用いて,Oesch(チューリッヒ大)らはプリオン蛋白遺伝子が正常細胞に存在し,正常なプリオン蛋白(PrPC)が作られることを明らかにした。その後,遺伝性プリオン病の家系にこの遺伝子の変異が発見され,マウスでの遺伝子操作が開始された。とくにノックアウトマウスでPrPCがなければ実験的感染が起こらないことや,ハムスターの遺伝子を導入したトランスジェニックマウスが,ハムスターと同一の潜伏期間で発病し,感染の際の動物種の壁が説明可能となった。また遺伝性プリオン病の点変異を導入したマウスが無処理でも発病し,患者類似の病変を示し,遺伝子病の側面も説明できるようになった。さらに正常細胞にみられるPrPCとプルシナーが抽出した感染性プリオン蛋白(PrPSc)の,一次構造は同一であるが立体構造に差違があり,PrPCに多いα-helix構造がPrPScではβ-sheet構造に変わることが判明した。表に示すプリオン研究の歴史は,かつて非難の集中したプリオン仮説を着実に実証しつつあり,正常蛋白質の立体構造の変換が遅発性感染症と遺伝子病の両面を持つ疾患の原因となり,従来の病原体の概念を変えたユニークなプリオン仮説が解明されつつある。正確な実験結果に基づき大胆な仮説を提唱し,それを一歩一歩立証していった彼の手法が,ノーベル賞の単独受賞をかち取ったものと思われる。
感染性プリオン病
プリオン病の感染症としての特徴を示す事件がいくつか見られる(表)。ニューギニアのクールーはFore族が肉親の死を葬うために行なった食人の儀式を介して感染したもので,その中止により消滅に向った。プリオン病の経口感染はマウスでの感染実験で容易に再現され,腸壁のリンパ節であるPayer板よりPrPScはとり込まれる。動物の代表的プリオン病である羊のスクレイピーは,200年以上の昔から北欧を中心に流行しているが,種の壁を越えて他の動物に大流行したり,ヒトに感染することはないと言われてきた。
ところが1985年に英国の乳牛に発生したウシ海綿状脳症(BSE,狂牛病)は,またたく間に英国全土の牧場に拡がり,その発生状況から配合飼料に混入したスクレイピー感染羊の蛋白質が疑われ,配合飼料は禁止されたが,罹患牛の総数は1996年春までに16万頭を越えた。この状況下で1994年から1年8か月の間に,新しいタイプのCJD(new variant CJD)患者10名が英国で発生したことから,BSEとの関連性が否定できないとの英国政府の発表が1996年3月になされた。その特異な臨床,病理,免疫化学的特徴は,従来のCJDとはまったく異なり,BSEとの関連性がますます濃厚になりつつある。患者数もフランスの1例を含め,ほぼ同一のスピードで増えつつある。
前述のプリオン蛋白の立体構造の変換に重要といわれるコドン90番から155番の間に,羊と人のアミノ酸配列に6か所の違いがあり,種の壁を作っていると思われるが,その内の3か所で牛と人のアミノ酸は同一である。そのため牛が一種の中間宿主となる可能性も考えられる。
乾燥脳硬膜によるプリオン病
1996年3月の英国政府の発表を契機に,わが国でも厚生省の緊急研究班(班長=佐藤猛氏)が組織され,プリオン病の全国調査が行なわれた。その結果わが国には新変異型CJDは存在しないが,乾燥脳硬膜製品を使用した脳外科手術後に発生したCJDが平成9年7月までに46人存在することが判明した。さらに脳外科学会独自の調査で,あらたに数名の症例が判明したといわれる。感染源としてドイツの1社が1987年5月までに生産した製品による疑いが強い。これは剖検例から得た脳硬膜にプリオン病患者のものが混入しておれば,その不活化は通常の滅菌法では不可能なためである。今回の犠牲者の手術後,発病までの平均潜伏期間は約7年であるので,今後の新しい患者発生は減るものと思われる。しかしまれな疾患といわれたプリオン病が,研究の進展に伴い新しい疾患群の発見に結びつく歴史が終わり,この難病の征服の歴史が今年から始まることを期待したい。
| |||||||||||||||||||||||||||||||||||||||
