対談 癌化遺伝子研究の現在
“2ヒット・セオリー”と“Cancer Genetics”をめぐって
 |
|
| Dr. Alfred G. Knudson Fox Chase Cancer Center |
樋野興夫氏 (財)癌研究会癌研究所実験病理部長 |


“2ヒット・セオリー”をめぐって
稀な「遺伝性癌」に着目
――本日は,発癌の“2ヒット・セオリー”で世界的に有名なFox Chase Cancer Center/NCIのKnudson先生が来日されたまたとない機会ですので,かつてKnudson先生のもとに留学されたご経験をお持ちの樋野先生にご出席をお願いしまして,「癌化遺伝子(癌遺伝子と癌抑制遺伝子の両方を含む;以下,「癌化遺伝子」)研究の現在:“2ヒット・セオリー”と“Cancer Genetics”をめぐって」と題しまして,癌化遺伝子研究の歴史と現在の最新の研究成果や将来の展望をお聞かせいただければと思います。それでは,樋野先生よろしくお願いします。樋野 今春のJournal of the National Cancer Institute誌(Vol.89.No.7.April 2)に「2ヒット・セオリーの提唱から25年」という特集記事が載っていますが,まず最初に,2ヒット・セオリーに関するエピソードなどをKnudson先生にお聞きしたいのですが。
Knudson 私が2ヒット・セオリーを提唱した頃(1971年)は,癌に関してさまざまな学説がすでにありました。しかし,細胞がどうして悪性化して,発癌にいたるのかということをうまく説明できるよい情報はあまりありませんでした。それに,癌に対する考え方は主にウイルスや放射線,化学物質に基づいたものでした。
放射線や化学物質が発癌の原因になるという点に関しては,Boveri博士がすでに今世紀の初め(1914年)に体細胞変異が癌の原因になるという「癌の突然変異」説を提唱していました。そして,1960年の慢性骨髄性白血病におけるPhiladelphia染色体の発見によってこの説が具体的に支持されました。
ところが1971年までは,他の癌でPhiladelphia染色体のような特異的遺伝子変化の報告はありませんでした。ですから,体細胞変異説に対して,疑問を持っている研究者も多かったのです。ある種の癌は明らかにウイルスが原因であることはわかっていましたので,体細胞変異説は放射線と化学物質による発癌を説明するものであると考えられていました。
しかし,ある種の癌は体細胞変異説にあてはめることができると思われていました。それは「遺伝性癌」です。私自身は,同じ癌でも遺伝性のものと非遺伝性のものがあり,それらはいったいどのような関係にあるのかという問題に大変興味を持っていました。
小児腫瘍が専門だったからかもしれませんが,私が特に興味を持ったのは,どうして小児に生まれながらの癌ができるかという問題でした。というのも,小児癌は成人型の癌に比して環境因子による影響が低いからです。とりわけ興味深く感じたのは,RB(Retinoblastoma:網膜芽細胞腫)でした。
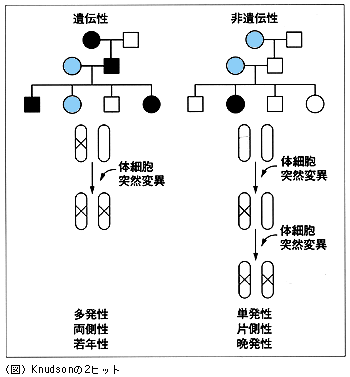
遺伝性のRBと非遺伝性のRBの解析
Knudson 当時,癌研究者の間では,遺伝性癌は大変めずらしいものだと考えられており,通常の成人の発癌のメカニズムに遺伝性癌は寄与しないだろうと考えられていました。その理由の1つは,遺伝性癌を説明できるよい学説が,当時はなかったからです。もう1つの理由は,当時は遺伝子マッピング,さらには遺伝子を単離・同定する手段がありませんでした。ですから私は,遺伝性のRBと非遺伝性のRBはどういう関係があるのか調べてみました。重要な糸口はいくつもありました。その1つは,親がRBを発症したが子供は正常,しかしその子供,つまり孫にRBが発生しているケースがあげられます。1世代を超えて伝わっているわけです。つまり,病因遺伝子を受け継いでも,腫瘍発生には十分ではなく,さらに他のeventが必要ということになります。
それから,両眼にRBが発生している場合は,RB病因遺伝子のキャリアーであるということを私は知りました。オランダの研究者が,両眼にRBが発生している場合,その子供の50%はRBが発生するという報告を出したからです。そこで私は,両眼にRBを発生している子供と,片眼だけRBが発生している子供の年齢を調べてみました。普通,片眼だけに発生している場合は遺伝しないケースです。
こういう方法から,遺伝性と非遺伝性を比較してみました。その結果,遺伝性の場合は最初のヒットは生殖細胞ですでに起こっており,2回目のヒットは体細胞(somatic cell)で起こることがわかりました。ところが,非遺伝性の場合は2つのヒットはともに体細胞で起こることがわかりました。
単純な系から法則を導く-RBは発癌のヒットが最少
樋野 当時は,発癌には多くのステップ・ヒットが必要だという考え方が一般的であったと思いますが,具体的にヒットの数,ヒットのタイミングについて特異的な考えはありませんでしたね。Knudson そうですね,ほとんどの研究者は多数のeventが必要だと思っていました。しかしながら,これでは遺伝性と非遺伝性の関係を説明することは困難でした。
私は,最も少ないヒットを経て発癌するものが見つかれば,何かアイディアが得られるのではないかと思いました。そういう点では,RBは幼児に発病しますから,時間的にも最少のヒットで癌化に至ると思いました。
樋野 RBは大変稀な小児癌です。ほとんどの人が,RBは通常,成人に見られる乳癌や大腸癌とは違うと考えていたと思います。しかし先生は,このRBという非常にめずらしい癌に集中されました。これは重要なポイントだと思います。
Knudson ええ。医学の研究においては,めずらしいことが一般的な事項についていろいろと教えてくれることがよくあります。
また,稀なできごと の中には,非常に単純な場合がありますから,複雑な事柄を研究するためには,よい出発点になります。
樋野 シンプルな系を選び,明確な結果を得て,さらに複雑な現象のメカニズムに適用する。これは大変教訓的なことだと私は思います。
稀な小児癌からanti-oncogeneとoncogeneを学ぶ
Knudson ご存知のように,現在は癌抑制遺伝子(tumor suppressor gene)と呼ばれておりますが,私は当時,「anti‐oncogene」と名付けました。ウイルスのoncogeneは,すでにわかっていましたが,宿主にも相同なproto-oncogene(癌原遺伝子:正常で,しかも発癌性を潜在的に秘めている遺伝子)があることがわかったのは1976年です。oncogeneの異常が発癌の原因になっているということが初めて示されたのはバーキットリンパ腫で,それは染色体転座によるものでした。ここで私が小児科医として指摘したいことは,われわれはめずらしい小児癌であるバーキットリンパ腫からoncogeneを学び,まためずらしい小児癌であるRBからanti‐oncogeneを学んだことです。すべての癌に通用する『カギ』を,小児の珍しい癌からわれわれは学んだわけです。成人の癌は大変複雑ですから,基本の法則を学ぶことはとても難しいです。
樋野 先生は1971年に,その2ヒット・セオリーを「Proceedings of the National Academy of Science」に「突然変異と癌-網膜芽細胞腫の統計的研究(Mutation and Cancer: Statistical Study of Retinoblastoma)」と題して発表なさいました。それから1983年に,Dr.Sparkesが「Science」誌に,またDr.Caveneeが「Nature」誌にそれぞれこの理論を実証する論文を発表しました。そしてついに1986年,WeinbergらのグループによってRBの原因遺伝子単離がなされました。
しかし,1970年代はoncogeneの研究が中心で,癌抑制遺伝子の研究はあまり盛んではなく,先生が“anti-oncogene”という言葉を使ってから注目されるようになったとお聞きしていますが。
Knudson そのとおりです。1982年の会議で,私が初めてanti‐oncogeneという言葉を使いました。それ以前は,“recessive cancer gene”というふうに考えていましたが,私は名前が必要だと思いました。
その時(1982年)すでに,oncogeneについてわかっておりましたが,RBに関する論文を発表した時(1971年)には,proto-oncogeneの存在についてわかっていませんでした。ですからある意味では,われわれはanti‐oncogeneの存在の証拠のほうを,proto-oncogeneより早く持っていたことになります。
癌抑制遺伝子の数はどれくらいあるのか
樋野 その後,いろいろな癌抑制遺伝子が発見されました。およそ50種くらいの癌抑制遺伝子があるかと思いますが。Knudson そうですね。遺伝性に癌が起こる疾患は,およそ50くらいありますね。もちろん,2つの異なる遺伝子が同じ表現型をとる可能性もありますし,1つの遺伝子が,変異の起こり方によって2つの表現型を示す可能性もあります。さらに,変異が非常に稀であるとか,癌の浸透率が低ければわかりにくいです。
胎児が死ぬ可能性もありますから,その場合は知ることはできません。ですから癌抑制遺伝子の総数は正確にはわかりませんが,私はおよそ50から100あるのではないかと思っています。しかし,これはあくまでも概算であって,本当のところはわかりません。
発癌過程に初めて数学を導入
樋野 先生の当時の研究の背景をもう少し詳しくお聞かせ下さい。というのも科学を深く研究するためには,どのようなアイディアを持って研究を始めるかは重要なことだと思います。先生はそれについて,哲学があると思います。Knudson それについては2点あります。1点は,すでに知られている他の癌についての学説と自分の考えとの関係です。その1つに,「多数の変異」モデルがありました。通常の癌は年齢に比例して級数的に増えるということがそのモデルに示されていました。そのモデルの問題点は,もし細胞が増殖しているならば,eventが多くあると考えがちです。しかし,実際はeventはもっと少ない可能性があります。それから,胎児の腫瘍の場合では細胞は増殖していますから,それも考慮に入れなければなりません。
そこで,私は2つのアイディアを持って,1つの数学モデルを作りました。1つは,突然変異と標的細胞の数をどういうふうに統一的にまとめられるかということです。もう1つは,非遺伝性のRBを普通の体細胞変異率で説明できるかどうかということです。体細胞変異は非常に稀でほとんど2ヒットは起こらないから,RBに罹る人はいないと思っている人が多かったです。
しかし,実際は増殖している細胞集団の中で,最初のヒットが起きているのです。1個の細胞ではないのです。1回のヒットによって,何千もの細胞がヒットを受けているのです。それらのうちの1つの細胞が2ndヒットを受けて癌になるわけです。
これを計算した結果,実験的に観察できる変異率と同じレベルで腫瘍が発生していることがわかったわけです。
樋野 先生は「発癌の研究に初めて数学を導入した」と言われましたね。
Knudson まあ,数学者に向かって「これは数学だ」と言うのは遠慮したい気持ちがあります。そんな複雑な数学ではないという意味です。
当時も,数学上のモデルがありましたけれども大変簡単なものでした。多数のeventとか,級数的増加に関するものだけでした。しかし,われわれは人体の組織の中で何が具体的に起こっているのかを考えました。最初はどれぐらいの細胞でスタートして,最後はどれぐらいの細胞になるのかです。
樋野 先生は小児科医であると同時に,遺伝学者でもあり,そのうえ数学者でもあり,3つの分野すべてに通暁しています。これはとてもめずらしいことです。
癌化遺伝子研究の現況
癌化遺伝子研究の成果


樋野 ところで,現在の癌研究について,ご意見をお聞かせ下さい。
Knudson まず,癌遺伝子と癌抑制遺伝子ですが,それらが発見されたことによって,ウイルス発癌とその他の発癌との関係がわかり,体細胞突然変異説とウイルス説との間の対立が解決されたことです。
どのような解決だったかと言うと,RNAの腫瘍のウイルスは,proto-oncogeneと相同なoncogeneを持ち,DNA腫瘍ウイルスはanti-oncogeneの作用を抑制させるタンパク質を作っているということが,現在は解明されました。
近年,われわれは癌に関する多くの知識を得ました。例えば,癌遺伝子にしろ癌抑制遺伝子にしろ,その遺伝子はどのように機能しているか,ある程度わかるようになりました。これは非常に大切なことです。 というのも以前は,癌研究は他の基礎科学研究の分野から少し距離がありましたが,今や一緒になってきました。例えば,生物学の専門家たちも発癌のメカニズムや癌で発見された遺伝子に対して興味を持つようになってきたのです。
また,臨床医学の面でも大きな成果をもたらしました。例えば,これまでは癌の化学療法においては,化学物質の投与によって癌細胞と同時に,正常細胞も殺していました。しかし,癌細胞だけを殺し,正常な細胞は殺さない化学物質が作れるのではないかと考えるようになりました。この方法はまだ実現できていませんが,新しい方法と言えます。
これからの癌治療と予防-癌の発生を遅らせる
Knudson さらに,癌の家系の研究が進み,いわゆる遺伝子診断が可能になりました。病因遺伝子の有無によって,予防対策を立てることも可能になりました。特に多段階発癌の場合では,その過程の中のワンステップを遅らせることによって,発病を遅らせることができるようになるかもしれません。いずれ発病するにしても,75歳で発病するのと45歳で発病するのとでは大きな違いです。今後,発癌研究は癌の治療にも予防にも関係してきます。樋野 癌発生は避けられないと言われていますが,治療にせよ予防にせよ新しい展望が拓けてきたわけですね。
Knudson そうです。癌は体細胞変異で起こり,癌の発生は避けられないと考えられています。われわれがどのように努力しても,ある程度の変異はどうしても起こってくると思います。これは「自然突然変異」と呼ばれ,除去できませんから,癌は避けられないものであろうと。しかし,そのような癌は全体からみれば,比較的少ないかもしれません。
ですから,変異を増加させる,あるいは癌に罹る可能性を高くする環境にあるものが見つかれば,予防によって除去できるかもしれません。突然変異によってすでに癌化がスタートしていても,また生まれつき病因遺伝子を持っている場合にもそうですが,癌の発生を遅らせることができるはずです。例えば乳癌の場合,アメリカの方が日本より多いと思いますが,アメリカでは乳癌は40歳代の女性の大きな死亡原因です。しかし,60歳まで発病を遅くさせるようにするだけでも改善になります。ですから1つの目標は,ある年齢以前の癌死をなくすことです。
小児の癌は少ないヒットで起こっているので,予防は難しいと思います。その反面,治療は成人の癌よりも効果が上がると思います。小児癌を完全には予防できないので,癌の治療を続けたほうがいいと思います。しかし,成人の癌は予防のチャンスが大きいと思います。
Cancer Geneticsについて
Cancer Geneticsの2面性


樋野 ところで,ヒトの臨床癌および動物の癌を用いて,遺伝子変異の解析が盛んに行なわれていますが,いったいどの変異が発癌にとって重要であるのかなかなかわかりません。そういう意味からも,Cancer Geneticsはとても大切な概念だと思います。
先生のCancer Geneticsの定義をお聞かせいただけますか。
Knudson Cancer Geneticsには2つの面があります。1つは遺伝性癌です。つまり遺伝性癌を作る遺伝子はどれかということです。
もう1つは,正常細胞にはないけれども癌細胞にある遺伝子変異は何かということです。言い換えれば,宿主の遺伝子と腫瘍の遺伝子が違うということです。
問題は,腫瘍の中の遺伝子変異は,単なる発癌のプロセスにおいて付随的に起こっているものがあり,腫瘍の原因ではないものがあるということです。そのような遺伝子変異の解析に無駄な時間を費やしたくないし,またそれらの解析からは何もわからないでしょう。遺伝性癌の病因遺伝子が見つかれば,それは重要です。確実な遺伝子は,ウイルスや遺伝性癌から得られてきました。
癌の遺伝子診断について-正確な知識を
樋野 一方で,遺伝性癌については,社会的,倫理的な問題が生じています。Knudson 現在,遺伝性癌の病因遺伝子は20ほどクローンされています。遺伝子の中には通常の癌を起こすものがあります。特にBRCA1,BRCA2と遺伝性の非腺腫性大腸癌(HNPCC : hereditary nonpolyposis colorectal cancer)です。
1%の人は,この中の病因遺伝子の1つを持っていると思われます。以前われわれは,病因遺伝子を持っている人は稀だと思っていましたが,1%という数字はかなり多い数です。ですから,人々に正確な情報を与えるためには,われわれの知識を改善する必要に迫られていると思います。
癌に罹る可能性はどれくらいあるかはみなが知りたがっていることです。誰でも癌に罹る可能性はあります。ゼロにはなりません。しかし,5%対90%ではまったく違います。
病因遺伝子を持っている家系の人でも,全員ではありませんが,知りたがっている人もいます。自分はその遺伝子のキャリアーか,そうでないのか。もしキャリアーでなければ,普通の人と同じように生活してもいいのですから,思い悩む必要もありませんし,特別な検査,例えば乳癌の場合ならmammographyの検査をする必要もないわけです。BRCA1のキャリアーの30歳の女性は,定期的にそういう検査をするほうがいいと思うかもしれませんが,そうでない場合は,そういう検査は必要ないかもしれません。乳癌に罹る危険度が少ないからですし,またみながそういう検査をするのは大変な金額になるわけです。
しかしまた,病因遺伝子を持っているということがわかったならば,保険会社は保険に入らせてくれないことにもなりかねません。あるいは,就職の問題も出てきます。アメリカでは,これは大きな社会的問題になっています。
さらに大きな問題は,われわれの情報があまり正確でないケースが多いことです。例えば,BRCA1の変異を持っている女性が60歳までに乳癌になる可能性は80%なのか,あるいは60%なのか,それとも40%なのか,それを伝える医師自身にもわかりません。
われわれはできるだけ情報を正確にしたいと思っています。現在アメリカでは,病因遺伝子のキャリアーの自然史についての正確な知識を得る努力をしています。大きなポピュレーションの検査も必要ですし,複雑なインフォマティックも必要です。
しかも,他人が機密の情報,あるいは個人識別の情報を手に入れることができないようにする必要がありますので,問題はさらに複雑になるわけです。情報は科学者に届くけれども,科学者は誰の情報かわからない。情報の結果とその人のアイデンティティを別々にしなければなりません。ですから,日本でもそうだと思いますが,アメリカではこの状況を改善する努力がなされています。
癌の遺伝子治療について
樋野 わかりました。次に,癌の遺伝子治療については,どのように考えられていますか。Knudson 今後,治療についての新しいアイディアが出てくるものと思います。
最初は病因遺伝子がクローンされたとき,みんなが「正常遺伝子を戻すのか」と思いました。遺伝性疾患の場合は劣性遺伝の疾患が多いですから,100%回復する必要はないので,ある時に正常遺伝子を戻せば効果があるかもしれません。両方の遺伝子が悪い場合,例えばcystic fibrosisとか,Tay‐Sacks病とか,鎌状赤血球症のような先天性代謝異常があります。しかし,片方の遺伝子だけ悪い場合では,その人は大丈夫です。ですから,50%でよいわけです。
しかし,10%から20%でもかなりいいという遺伝子が多いです。ですからその場合は,正常遺伝子を戻して,20%,25%とか30%の回復ができればそれで十分です。しかし癌細胞の場合,30%の癌細胞のポピュレーションを直してもどうにもなりません。他の70%はどんどん増殖するからです。従って,遺伝子治療をただ正常遺伝子を戻しておく,というふうに解釈するのは大きな問題だと思います。
しかし,別の方法の遺伝子治療もあります。例えば,特異的に細胞を殺す方法とか, 癌細胞の中に新しい認識分子があると考えて,免疫を増強する方法です。このように人によって遺伝子治療の意味するところが違います。
しかしながら,治療に関するもっと正確な知識や,癌細胞を殺すにしろ,更生させるにしろ,さらに新しい知識と情報を得ることが最も希望の持てることだという点では多くの研究者の意見が一致しています。
若い科学者への提言
樋野 おっしゃられるように,もっと多くの情報が必要だと思います。ところで,最後に若い科学者にサジェスチョンがありましたらお聞かせいただけますか。Knudson それは難しい質問ですが……。 ある問題に対して面白いアイディアを持っていても,その技術がないと何もできません。例えば,Boveri博士のアイディアのように,当時はやり方がなかったために,長い間そのアイディアが日の目を見なかったということもあります。
もう1つの極端な例は,技術をすべて持っている人の場合です。技術を持っていても,みなが考えつきそうな事柄を研究していては,問題解決までの競争になるにすぎません。科学者にとって本当の技は,他の人が見えないことを考え出すことです。しかも,それはアプローチ可能な,テスト可能なものです。
偉大な科学者と呼ばれている人たちは,みなそういう能力があったようです。ですから,何か意外なことをするのだと思います。
樋野 本当にそう思います。多くの人は科学はそういうことだとわかっているのですが,世の中はビッグサイエンス化して,競争的なことが多く,なかなかユニークなことは少ないように思われますが……。
Knudson そういうことも大変に役に立ちます。われわれはたくさんのことを知ることが必要です。しかし,誰かが大変役に立つ新しいものの見方を考え出す時は,特に面白いです。
樋野 そういう人たちに対する研究費は,アメリカではどうですか。
Knudson あまりにも新しすぎるアイディアを研究をするために誰かに研究費をお願いすると,それはクレイジーだからお金は出せないと言われるかもしれません。どの国でも,これをどうすればいいのかは1つの大きな問題ですね。
樋野 本日はお忙しいところ,長時間にわたりありがとうございました。
(終わり)
| ●Alfred G. Knudson Jr.
1976年より米国PhiladelphiaにあるFox Chase Cancer Centerのdirector,presidentを歴任。網膜芽細胞腫(Retinoblastoma)の発生機序に関して臨床医としての深い洞察から,遺伝性のものは1ヒット,非遺伝性のものは2ヒットの遺伝子変化で起こるという“2ヒット・セオリー”を初めて提唱。
|
