座談会 臨床薬理学-新しい世紀に向けて
| 水島 裕氏
(聖マリアンナ医科大学 難治研センター長) |
 |
| 猿田享男氏
(慶応義塾大学内科教授) | |
| 中野重行氏
(大分医科大学 臨床薬理教授) | |
| 衣非 脩氏
(日本製薬工業協会 医薬品評価委員会委員長) |


治療医学の中の「臨床薬理学」
臨床薬理学の3つの柱
 水島〈司会〉本日は,「新しい世紀に向けて臨床薬理学はいかにあるべきか」というテーマについて先生方のご意見をおうかがいしたいと思います。まず,治療医学における臨床薬理学の位置づけについてですが,基礎の立場から中野先生に,臨床の立場から猿田先生にお話しいただけますか。
水島〈司会〉本日は,「新しい世紀に向けて臨床薬理学はいかにあるべきか」というテーマについて先生方のご意見をおうかがいしたいと思います。まず,治療医学における臨床薬理学の位置づけについてですが,基礎の立場から中野先生に,臨床の立場から猿田先生にお話しいただけますか。
中野 治療において薬物を使う機会は大変多く,医薬品の有効性と安全性を考えると,合理的かつ適正に使うことが何にもまして重要であることは言うまでもありません。そして,医薬品を適正に使うために必要な知識を集積して体系化し,またそれを正しく教育することが重要になります。これが臨床薬理学の第1番目の柱だと思います。
第2番目の柱は,使用している医薬品を正しく評価し,すでに存在している医薬品よりも優れた医薬品を開発していくことにあると思います。したがって,医薬品の有効性と安全性を科学的に評価することが必要となります。
第3の柱は,治療学の基礎という点で,患者と医師のよきパートナーシップの構築やインフォームドコンセントも入ってくるように思います。
この3つの柱が臨床薬理学の中心にあると思います。臨床薬理学は治療医学の大変重要な部分を担っているものと思います。
水島 臨床薬理学は,循環器を中心に発展したような点もあると思いますが,そのあたりも含めて,猿田先生,いかがですか。
猿田 医学教育において治療医学は非常に大切な学問ですが,日本の医科大学を見ると,臨床薬理学の講座が置かれているところが少ないこともあって,疾患の診断,病態は教えても,治療医学を教えていないところが多いように思います。それでは,臨床薬理学の講座のない医科大学ではどうしているかというと,薬理学の授業で薬剤の基本的なことを教え,実際にその薬を臨床でどのように応用していくかということはそれぞれの臨床科で教えていますが,それだけでは不十分です。
臨床薬理学への理解が浅い
水島 医薬品業界の立場から,衣非さんはそのあたりをいかがお感じになりますか。衣非 両先生のお話のとおりだと思います。ただ一般的には,臨床薬理学が医薬品を正しく評価し,科学的に適正に使用するための実践的な学問だということを理解していない人が多いのではないでしょうか。「治療学」や「治療医学」と言えばわかるのでしょうが,臨床薬理学という名前はもっと基礎的なニュアンスを強く与えているように思います。
現実問題として,臨床薬理学会の中でも猿田先生のような臨床の先生方の参加が少ないですね。傾向として講座が増えず,予算が付かないなど,うまくいかない一因もその辺にあるような気がします。臨床薬理学が治療に直結し,薬を正しく評価し,最小の副作用で最大の効果を得るためには不可欠な学問であることをもっとPRしなくてはいけないと常々感じています。
水島 わが国の医学界の大きな問題は,治療学が低く見られていたことがありますね。今後,臨床薬理学をきちんと理解してもらうために,医学部に講座を設けて学生に教育する。そのためにはよいテキストが必要になります。例えば中野先生たちのご努力によって『臨床薬理学』(医学書院刊)が出版され,私も目を通しましたが,とてもよい臨床薬理学の教科書だと思いますし,治療医学の臨床的なバックグラウンドになる臨床薬理学が,これからさらに発展することを期待したいと思います。
治験の現状と問題点
「治験とは何か」への理解を
水島 臨床薬理学の目的には医薬品の効果や副作用を正しく評価すること,および実際に治療するということもありますが,もう1つの目的に新しい薬が開発された時,あるいはそのフォローアップとして評価すること,いわゆる臨床試験--治験があると思います。現在,日本で行なわれている治験をめぐる問題点についてお話しいただけますか。猿田 治験を適正に行なうことは重要ですが,その前に「治験とは何か」を十分に理解している臨床医が少ないことも大きな問題ですね。臨床薬理学の教育を受けていないために,治験とは何かを理解せずに治験に参加している方がいます。極端なことを言うと,これまでは,新薬開発の治験の話が来ると,治験の意義を理解せず研究費のためにすべての治験に参加してきた方もいたと思います。さらに言えば,きちんと治験を行なうにはそれなりの労力を必要としますが,片手間仕事で行なっているように思います。そういう点で臨床医側には,これまでのあり方に関して反省しなければならない点が随分あるように思います。
しかし一方で,5-6年前から徐々に見直され,先生方が治験についてかなり理解するようになったこともまた喜ぶべき事実 だと思います。最近になって治験が進まなくなったのは,治験に対して患者さんからきちんとした同意を得なければならないので,その同意がなかなか得られないためではないでしょうか。
衣非 薬を作る側から見ますと,今のお話の背景には,臨床の先生方に十分に興味を持っていただけるだけの価値のある治験薬が少ないこともあったかと思います。私どもとしては,「ぜひ治験をやりたい」と思われるような新薬を研究開発していくことが必要ではないかと感じています。
治験の仕組みについては,治験のあり方がよく理解された上で,治験依頼者も先生方も取り組むことが非常に大事だと思います。そういう意味では,ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use;「医薬品規則ハーモナイゼーション国際会議」)での合意に基づいて,GCP(Good Clinical Practice;「医薬品の臨床試験の実施に関する基準」)が改定されましたが,これを広く知っていただくことが,治験とは何かについての啓蒙や普及に役立つのではと期待しております。
インフォームドコンセント: 治験薬,被験者,治験担当医
水島 中野先生,現在厚生省で治験に関して研究をおまとめになっていますが,どういうことが討議されているのですか。中野 厚生科学研究の「適正な治験の実施方法に関する研究班」のことですね。これは平成6年度から始まった3年間の研究活動です。適正な治験のあり方を考えますと,「科学性」の問題と「倫理性」の問題の2つに集約されるように思います。
治験,つまり新薬の臨床試験は,よい治験薬があって,優秀な臨床医がいるだけではうまくいきません。被験者として参加していただく方-特に患者さんや健常者-の協力があってはじめてうまくいきます。治験薬(その背後にある製薬会社),被験者(その背後にいる国民),治験担当医(それを支える多くの医療従事者)の間で作られる基本的な三角形ができ上がってはじめて成功するものです。したがって,科学性という面ももちろん重要ですが,倫理的な側面もそれに劣らず重要です。
そこで最初に私どもの研究班で行なったのは,わが国の治験におけるインフォームドコンセントの問題点をはっきりさせることでした。その上に立って,わが国の治験のインフォームドコンセントのあり方をよりよく改善するための方策が見つかるのではないかと考えました。そこで,全国的に他施設で実施された治験に実際に参加した治験担当医と,被験者になった患者さんにアンケート調査を実施してみました。
ポイントだけお話ししますと,臨床試験で最も重要な手続き,例えばプラセボを使った比較対照試験,無作為割りつけ,二重盲検法などが医師にとって実は最も説明しにくく,患者さんにも医師が思っている以上に理解されていない,という実情がはっきりしてきました。そこで,欧米で育った治験の被験者へのインフォームドコンセントを,今後どのようにわが国で育てていったらよいのかということを,まず最初のまとめにしたいと考えています
治験における科学性と倫理性
水島 私も20年ぐらい前から,中央薬事審議会(中薬審)などで医薬品の臨床試験の審査を行なってきたのですが,この「科学性」と「倫理性」について,ずいぶんディスカッションをしました。日本の治験では,確かに科学的に効果があるという判断はできます。臨床薬理学的に意味がある点ではいいのですが,長い目でみて患者さんのために本当に役に立つ薬かどうかを評価する,という点ではあまり具合がよくなかったのではないかと思います。外国で治験を行なう場合,長期フォローアップや死亡率,また手術件数が減少し,明らかに人類の幸せに役に立つかどうかを重視して判定します。そもそも日本の医薬品開発の歴史は欧米の模倣から始まっていますが,科学的な評価はできても,この薬に本当に意味があるのかという観点からの評価が足りなかったのではないかと思います。日本でもそういうことが必要だと思うのですが,猿田先生,いかがでしょうか。
猿田 最近になって,新薬の治験の開始に際して,この薬はどれだけ役立つのか,本当に健康増進に,あるいは世界的にも役立つのかを考えるようになったと思います。
しかし,10年前は決してそうではなかったですね。もちろんそのような時代でも,しっかりした製薬会社はそれらのことも視野に入れていましたが,その後あまりにも治験が増え,私たちも振り回されてしまったように感じます。
水島 製薬会社の話が出ましたが,衣非さんはどうお考えでしょうか。
衣非 変わりばえのしない新薬が多すぎたのは,継続的な薬価の低下や,後発品が続出したこともあって,自転車操業的に目先だけちょっと変えた新薬を作らなければ,やっていけない状況に追い込まれたことが原因になっているのは事実だと思います。
しかし,日本製薬工業協会が公式に表明している見解は,もうそういう時代は終わったということです。世界に通用する画期的な新薬を開発しなければ,日本の製薬企業は生き残れないということです。すぐにはできないにしても,これをいかに早く現実のものにしていくかが,われわれの直面している課題です。
改定されたGCPについて
国際化の中での臨床薬理; 主な改定点
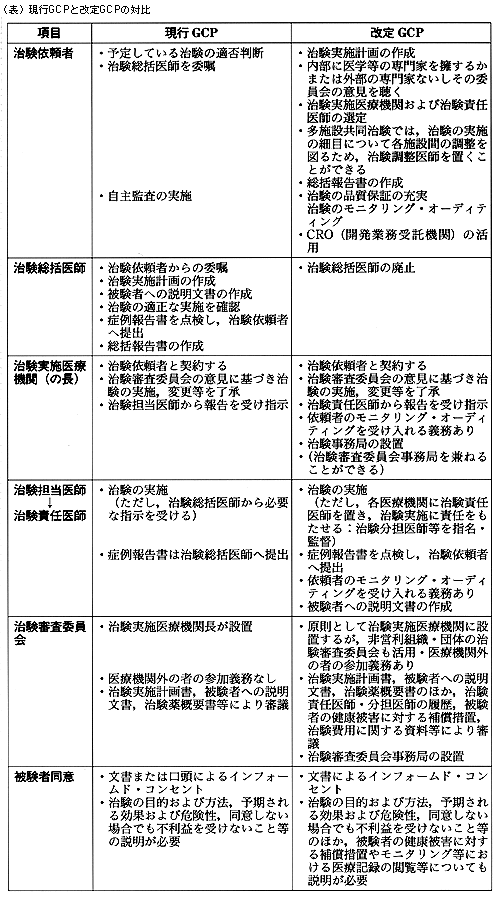
水島 次に治験の問題とGCPの国際化の問題に移りたいと思います。1つ申し上げたいのは,製薬会社の方は治験やGCPについてよくご存じなのですが,医師の側では,治療に詳しい臨床家でも,ほとんど知らない方がかなりいます。そこで衣非さんから,今回のGCPの改定の中で,どこが一番変わったのかをお話しいただけますか。衣非 インフォームドコンセントのことからいうと,かなり細かい規定があり,説明すべき事項が大幅に増えていることがあげられます。しかも,口答による同意をまったく認めておらず,すべて文書同意,いわゆる「written informed consent」になっています。さらに,この説明文を作成するのは医師の責任ということになっています。
これらのことを今後,名実ともに定着させていくためには,相当の努力が必要になると思います。
水島 全体的にはいかがでしょうか。
衣非 全体の枠組みについては,まず医師や製薬企業など,治験に関与する者の責任が非常に明確にされています。これまでのGCPは,治験の責任は治験依頼者にあるのか治験総括医師にあるのか,が不明確な点がありました。ところが,改定GCPでは,「全体の責任は治験依頼者が負う」ことが明確にされました。その具体的な表れとして,医療機関に対するモニタリングや監査(オーディット)の実施が義務づけられています。反対に,「治験総括医師制度」はなくなりましたが,治験を行なう医療機関には,治験全般に責任を負う「治験責任医師」を置くように規定しています。
インフォームドコンセントとならぶ倫理性確保のもう1つの柱である治験審査委員会については,委員構成を充実させ,評価に耐えられる公正な審査ができるようにする仕組みが求められています。平成元年(1989年)にわが国に初めて導入されたGCPと基本骨格は同じですが,それぞれの要素が非常に深まりを増しています。それが治験の国際化を踏まえて改定されたGCPである,とご理解いただけたらよいと思います。
水島 中野先生,モニターについてご説明いただけますか。
中野 GCPの国際化については,今,衣非さんが言われたとおりです。言い換えると,今後の医薬品開発は地球規模で全体で行なっていこう。時間的な資源,経済的・人的資源も含めて,医薬品開発に要する資源をできるだけ節約していこう,という大きな流れの中にあるように思います。そうすると,わが国の医薬品開発のあり方も,欧米からも認められるものに変えていかなくてはなりません。
今までわが国で最も立ち遅れていたのは,先ほどから話題になっている臨床試験の科学性と倫理性の面です。欧米から見ると,日本はどうも実施法が欧米とは違う点が多いのではないかと捉えられがちだったと思います。
「モニタリング」,「監査」, IRBと治験チームの改革点
 中野 そこで,まず科学性の基礎になる臨床データの信頼性を,信頼性管理(クオリティ・コントロール),信頼性保証(クオリティ・アシュアランス)で行なうことになります。つまり,「モニタリング」と「オーディット」が新GCPに明記されました。この点が従来のGCPとの大きな違いの1つだと思います。
中野 そこで,まず科学性の基礎になる臨床データの信頼性を,信頼性管理(クオリティ・コントロール),信頼性保証(クオリティ・アシュアランス)で行なうことになります。つまり,「モニタリング」と「オーディット」が新GCPに明記されました。この点が従来のGCPとの大きな違いの1つだと思います。
その他に大きく変わる点としては,倫理性を保証する治験審査委員会の委員の構成の問題があります。「非専門家」はすでにわが国でも委員として入っていましたが,新GCPでは,委員には医療機関外の人も入り,「施設内治験審査委員会(Institutional Review Board IRB)」の審査を行なう方向になります。この点は大きな変化だと思います。
衣非 つけ加えて申し上げますと,治験チームの改革点は2点あると思います。
第1点はわが国の臨床試験は,多施設,しかも「超」多施設臨床試験が多いことが特徴だったと思います。そして,そこでは全体をとりまとめる形で治験総括医師が機能しており,これまで臨床試験を進めていく上では,重要な役割を果たしてきたと思います。ただ,従来のGCPに治験総括医師の仕事が12項目記載されており,そのすべてを治験総括医師が責任を持つと記載され,実施しにくいことまで書いてありました。そこで実情に合わせて,全面的に治験の責任を治験依頼者が負い,さらに各医療機関の治験責任医師の治験実施上の責任も明らかにするように変わりました。
ただ,多施設臨床試験は今後も残ると思います。その場合には治験調整医師に治験チームに入っていただきますが,アドバイザー的な役割を果たすようになることが大きな違いになると思います。
2点目は,実際に治験を実施する現場での問題ですが,わが国では非常に多忙な医師が,日々の診療の中に治験を組み込んで行なっているのが実情だと思います。今後は何らかの形で,治験をスムーズに実施できるようサポートする人材を養成していかないといけない。例えばリサーチ・ナースやスタディ・コーディネーターを養成していかないと,治験の質の向上はなかなか難しいのではないかと思います。
現場における諸問題
 猿田 その点に関して,現場で感じていることを申し上げますと,今回の改定GCPは確かに理想的なのですが,それを科学的,倫理的に行なおうとすると,現在のわが国の医療現場では,おそらく半数以上の施設はだめではないかと思います。
猿田 その点に関して,現場で感じていることを申し上げますと,今回の改定GCPは確かに理想的なのですが,それを科学的,倫理的に行なおうとすると,現在のわが国の医療現場では,おそらく半数以上の施設はだめではないかと思います。
リサーチ・ナースやコーディネーターがいれば,治験のための特別外来を別に組むことができます。そうなると時間をかけて診察し,患者さんもリサーチ・ナースの方といろいろと相談でき,患者さんにもメリットがあると思います。今後はそういう施設で治験をするのが理想的で,すべての臨床の先生方が治験をするという時代は終わったのではないかと思います。
中野 現実問題として,新しいGCPに沿って治験が実施できる医療機関や施設がどのくらいに減ってしまうのでしょうか。
水島 今の3分の1から4分の1ぐらいはできると思います。
猿田 そういう施設で,臨床薬理学の講座を作り,しっかり教育を受けた人が治験を担当すると,日本でも世界に通じるような治験ができるのではないかと思います。私自身も反省しています。1日に80~100人もの人を診るような忙しい外来で治験を行なうのは難しいですね。
水島 私は,一番のネックはハード面だと思います。あとは,研究費や資金があれば何とかなってくるのではないでしょうか。
猿田 治験費は高くなりますね。私がアメリカで治験を行なった時は,1人の患者さんを30分かけて診てました。いまは3分ですから,いかに違うかです。きちんと設備やシステムを作ればできると思いますが,問題は医療事情の違いです。
衣非 GCPの改定案では,さき程も申し上げたように責任医師を各医療機関に置くことになっていて,その先生が治験実施上の責任を負います。ただ責任医師は1人で何もかも全部はできませんから,一定の範囲内で業務を分担することができるようになっています。つまり,治験分担医師がいるわけです。さらに,サポートとして,治験協力者もいるという規定になっています。お話のあったスタディ・コーディネーターやリサーチ・ナースというのは,協力者に入るのではないかと思います。
このように各医療機関では,責任医師を頂点とした治験チームによって治験が行なわれる形で対応し,それが複数集まって多施設の治験が行なわれる,という仕組みが規定されているわけです。
水島 私は,1年ぐらいすればこのシステムが定着するのではないかと思います。
猿田 それと,製薬会社も発売後のことを考えて,できるだけ多くの先生方に知ってもらいたいために,多くの施設に治験を依頼してしまう,ということも1つの問題だと思います。
衣非 おっしゃるとおりで,これからは治験薬の数も施設も限定されてくるだろうと思います。
中野先生が「超」多施設と言われましたが,これまでのような形の治験は次第に行なわれなくなると思います。そのためにも,ある施設である治験を行なっている間は,それに集中していただくような形にならざるを得ないと思います。
水島 1つの施設で1年に1つの治験をやれば上等ですよね。
衣非 治験がオーバーラップしないようになれば,施設数が「超」にならなくてもできると思うのです。
水島 皆さんのご意見を一口で言うと,量より質の時代がやってくる,ということで一致するように思います。
医師は薬事法でも規制される
中野 それから,GCPの改定とともに,もう1つ現場の先生方に知っていただきたいことは薬事法の改定です。1996年6月に改正され,そして今年の4月1日から施行されています。薬事法には治験依頼者に関する事項はありましたが,今回の改正では治験を依頼された者,つまり医師も新GCPを守らなくてはいけないという義務が入っています。こういう重要なことが実際の医療の現場にあまり伝えられてないのではないかと思いますが。
猿田 おっしゃる通りですね。
中野 臨床薬理学が各大学で教えられれば徹底されていくのでしょうが,現状では各大学や医療機関で責任を持って,医療スタッフに最新の情報を伝えていく役割の人がいません。これまでの考え方ですと「医師は医師法で」ということですが,実は薬事法でも規制されているのですが,正しく伝わってないのではないでしょうか。
猿田 今の学生は,国家試験に出題されるので,医師法に関しては一所懸命勉強していますが,薬事法に関しての教育はあまり受けていません。
中野 ある日突然,「あなたは薬事法違反ですよ」と言われかねませんね(笑)。
水島 ご説明いただいたことの中には,すぐにはとても始められないものもあるのではないかいう意見もあると思います。
いま突然にオーディットやモニタリングといって,製薬会社の人が来て医師のカルテを見せろと言っても,うまくいきそうな気がしません。それともう1つは,臨床試験の各施設にリサーチ・ナースをというのもどうでしょうか。ですから,1年ぐらい遅れてやむを得ないかと思います。GCPのモデル地域を作り,グループで研究することになりましたので,猿田先生,その結果をみてからでしょうね。
ソフト・ランディングを
 猿田 そうですね。もう少し期間を置いて治験のやり方をしっかり確立してからでしょう。まずは治験の患者さんは,一般の患者さんとは別扱いということで,診療の場も体制がしっかり徹底できれば,カルテの問題も解決すると思います。
猿田 そうですね。もう少し期間を置いて治験のやり方をしっかり確立してからでしょう。まずは治験の患者さんは,一般の患者さんとは別扱いということで,診療の場も体制がしっかり徹底できれば,カルテの問題も解決すると思います。
治験に対する考え方を変えていかなくてはいけませんし,それに伴って各施設で診療場所やシステムの変更などの対応をしなければいけませんので,少なくとももう1,2年はかかると思います。
衣非 GCPでは,カルテなどを見せていただくことを「直接閲覧」(ダイレクト・アクセス)と呼んでいます。治験の結果として治験依頼者がいただく症例報告書の記載内容が正確かどうかを確認するための手段で,監査やモニタリングで行なうことになります。当面,医療機関のほうでその受入れ体制ができてないというお話は当然だと思います。
しかし,カルテを見ること自体が目的ではなく,あくまでも症例報告書の信頼性の検証に目的が絞られるわけですから,読み合わせをするという形もあって然るべきで,そういう形のソフト・ランディングしていかなくてはならないと思います。治験依頼者の製薬企業のほうでもそういうことができる人材を育てなくてはなりません。とはいえ,できるところから始めて,違反性,違法性を咎めるのを少し先に延ばすほうが,定着を早めるのではないかと思います。
猿田 現場の人間としては,新GCPの施行に伴って,治験というものがどのように変わるのかということを,先生方にしっかり理解していただくことが大切だと思います。私どもの各関連施設の先生方には,安易に治験を受けないようお願いをしているところです。きちんとできる施設においてのみ,治験をするべきだと思います。
中野 これまで毎年夏に,厚生省主催のGCPの説明会を行なってますが,医師の参加が悪かったように思います。これからは,実際に治験を担当する医師を対象とした講習会や研修会も,ぜひ実施していただきたいと思います。
それから,国際的にみると素晴らしいGCPの改定ですので,これをマイナスではなく,プラスに生かすようにしていきたいと思います。わが国の臨床試験の国際化を一気に促進する方向へ,そしてそのための支援システムを早急に作らなければならないと思います。
臨床薬理学の社会的役割:21世紀に向けて
臨床薬理学会はさらなる 社会的責任を担うべき
水島 話は変わりますが,臨床薬理学の社会的役割について皆さんのご意見をおうかがいしたいと思います。なぜこういう話題が出てきたというと,昨年臨床薬理学会長を努めた時,私は「学会は,学会としてもっと社会的責任を持つべきだ」と発言しました。エイズの事件なども,学会がもっとしっかりと責任を持っていれば,ああならなかったかもしれないし,今回の治験の国際化という問題も,学会が責任を持てばうまくいくのではないかと考えています。
猿田 社会的役割を果たすことも重要です が,まずは臨床薬理学の講座を増やさないといけません。何度も申し上げている通り,臨床薬理学講座を作り,きちんと教育する。残念ながら,私どもの大学にも臨床薬理学の講座はありませんが,そういうことの積み重ねによってはじめて社会的な役割を果たすことができるのではないかと思います。
水島 国会の委員会や文部省,厚生省も,臨床薬理学は大変重要な学問だから,講座を作ることには大賛成だと言いますが,どういうわけか,もうひとつ現場からの声が上がってきません。
中野 1996年7月に出ました文部省の「21世紀医学医療懇談会」の報告書でも,臨床薬理学は重要視されています。それから,厚生省がソリブジン薬害事件の反省の上に立って,2年ほど前から行なった「医薬品安全性確保対策検討会」の最終報告書にも,臨床薬理学は非常に重要だと位置づけられていますが,数講座しかないのが現状です。
治験の問題がマスコミで取り上げられるのは,概してネガティブなイメージですね。しかし,医薬品の臨床試験は本当によいものを評価し,人類の健康を守るための財産作りの営みですから,正しい理解のための広報活動やポジティブ・キャンペーンを展開するのも,学会の役割の1つではないかという気がします。というのも,患者さんにその意義を正しく理解していただかなくては,治験が健全に育たないと思います。「治験の空洞化」によって,欧米に臨床試験を頼ってしまい,「治験のただ乗り」などと批判されないようにしなければならないと思います。
それからソリブジン薬害事件もそうですが,薬そのものが悪いのかというと実はそうではなく,薬の使い方が悪いことが実際には多いのです。それにもかかわらず,使い方が悪いと薬そのものが悪いように言われてしまうのはおかしいです。治療における正しい薬物治療の意義と適正な使用法について一般市民に語りかけていく必要があるのではないでしょうか。
水島 「薬」「製薬会社」「治験」というと悪いイメージしかないですね。
中野 薬とその薬を作った製薬会社をセットにしてダメということになると,ついでにその薬を処方した医師もダメということになってしまう(笑)。
猿田 新しく発売された薬に対する十分な理解が医師に欠けていることも多いです。
中野 医薬品は,「薬プラスその正しい使い方」をセットにして始めて1つの商品であるという感覚が日本人に欠けているように思います。医師も正しく教育されていないし,国民もそうです。何かあると薬そのものが悪者になってしまうという感じがします。この点は直さないといけません。
21世紀における臨床薬理学
水島 最後になりましたが,21世紀における臨床薬理学はいかにあるべきかということをお話し願いたいと思います。
学会の社会的役割という話が出ましたので,1つだけ申し上げますと,日本の医薬品はどうも本当に役に立つものが少ない。開発もそうですが,市販薬もそうです。昨年12月の「JAMA」誌に,日本,アメリカ,イギリス,ドイツで使用されている新薬や開発された新薬がどういうものかという記事が載っていましたが,ひと口で言うとわが国で開発された夥しい量の新薬は,他の3国でほとんど使われてない。一方,アメリカその他で開発された役に立つと思われる薬は,日本では許可になっていないものが多いようです。
それから,その掲載号の最後に「アメリカの政府は,アメリカの国民にどうしても必要な薬剤は早期に許可する」と書いてありました。日本の政府もそのくらいのことが言えるような時代に早くなることが,私の21世紀に向けての展望です。
中野 日本は,戦後50年を越えて,今や経済大国と言われるようになりました。しかし,いろいろな面で国際的な貢献が乏しいことが指摘されています。
現代は国際化の流れの中で地球全体の規模で医薬品の開発を考えていく時代に入りました。これからは日本で開発したよい医薬品を,日本で評価して海外に送り出していく。いままでは,最終的な医薬品の評価を欧米に頼り過ぎていたと感じます。
例えば高脂血症治療薬のプラバスタチンがそうです。プラバスタチンは日本で開発された非常に数少ない世界に誇れる画期的医薬品ですが,最終的な臨床における有用性の評価は海外に頼っています。このような現実は,国際的にみると恥ずかしいこと ではないかと思います。今後は,日本でレベルの高い臨床試験が行なわれるようになり,日本から世界に向けてよい医薬品を送りだしていくような形にしていかないといけない。この点が21世紀の課題だという気がします。
衣非 いまの高脂血症薬と関連させて申し上げますと,QOLや生存率というデータがほとんど日本では出てきません。特に,本当のエンドポイントと言いますか,それを指標にした成績が出てこない。たくさん試みながらあまり成功しなかったのは,患者さんが途中でドロップアウトしてしまう率の高いことが原因でしょう。つまり長期フォローできなかったのがこれまでの姿だと思います。その理由の1つに,インフォームドコンセントが徹底していなかったこともあるのではないでしょうか。何をやろうとしているのかが,十分患者さんにも理解されていないために,決められた期間をきちんと来院してもらえない。あるいは具体的なメリットを感じてもらえないこともあるかもしれません。
21世紀に向けては,治験,臨床薬理,薬の評価に関して,医学,薬学関係者の範囲を超えて一般社会にももっと情報公開され,すべての人が知っている状態にならないといけないのではないでしょうか。学会や医師や製薬企業自身の改善に加えて,今後いかに情報公開を進めていくか,いかに密室性から脱却していくかが大きな課題になるように思います。最近,大阪の患者さんグループから製薬協に「治験に関して講義してほしい」とのお誘いがありました。患者さんのほうも少しずつ変わってきていることもありますので,21世紀にはオープンな中で薬の評価が行なわれるようにしていくことが重要ではないかと思います。
猿田 私は,臨床薬理や治験のことを考え直すいい時期にきており,きちんとした改革が行なわれ,世界と対等に治験などができる状態が始まるのが21世紀だろうと考えています。その点に関しても,臨床薬理学会がリードした臨床試験などが行なわれるような体制を作っていきたいと思います。それが実施され,軌道にのる時が21世紀であると思います。
水島 おっしゃるとおりで,臨床薬理や薬にまつわるさまざまなことがうまくいかないのは,国民の理解がもうひとつ不足しているところもあります。それぞれの分野の勉強や一般教養も大切ですが,医学,医療の分野は必ず自分にはね返ってくるものですので,初等教育も含めてこの分野の教育,普及が重要なのではと思います。そういうことも含めて,私ども自身の薬剤や治験に対する考え方をレベルアップするとともに,国民の知識をレベルアップする義務もあるのではないでしょうか。
本日はありがとうございました。
| モニタリング
治験依頼者により使命されたモニターが治験の進行状況を調査し,治験が治験実施計画書,標準業務手順書,薬事法に規定する基準,ならびにGCPに従って実施,記録および報告されていることを保証する活動。 監査(オーディット) 治験が治験実施計画書,標準手順書,薬事法に規定する標準ならびにGCPに従って実施され,データが記録,解析され正確に報告されているか否かを確定するため,治験依頼者によって指名された監査担当者が治験にかかわる業務および文書を体系的に独立に検証すること。 |
