| 連載 第21回 | 再生医学・医療のフロントライン | ||
再生医学・医療の産業化
| |||
■2010年 再生医療産業化のアウトライン
 バイオテクノロジーの産業化は,まず医療および製薬等医療関連分野において生体組織再生,ゲノム創薬として開花しつつあり,今後はさらに,個人ゲノム情報に基づき適切な患者に適切な治療を施す「テーラーメイド医療」,個人の体質をゲノム情報レベルで把握し未然に発病を防ぐ「予防医療」へと移行すると考えられる。
バイオテクノロジーの産業化は,まず医療および製薬等医療関連分野において生体組織再生,ゲノム創薬として開花しつつあり,今後はさらに,個人ゲノム情報に基づき適切な患者に適切な治療を施す「テーラーメイド医療」,個人の体質をゲノム情報レベルで把握し未然に発病を防ぐ「予防医療」へと移行すると考えられる。
1988年,米国NSF(米国科学財団)主催の生体組織工学(Tissue Engineering;TE)に関するワークショップが行なわれ,TE関連の潜在的世界市場規模48兆円と予測している。また,産官学の研究開発体制整備を開始した1996年,世界バイオマテリアル会議(トロント)において,FDA(米国食品医薬品局)主導のTE製品認可統一基準のためのワークショップが開催され,米国の当分野に対する並々ならぬ意欲が感じられた。現在TEベンチャー企業50数社,株式総額2000億円,従業員数3000人以上であり,年間開発費6億ドルの中にNIH(米国立衛生研究所),NIST(米国立標準技術研究所)等の政府資金も10%以上含まれている。
わが国においても2000年に開始された,いわゆるミレニアムプロジェクトによる再生医療に関する研究開発が,関西を中心に活発に行なわれており,理研の発生再生科学総合研究センターがその中核をなしている。また名古屋大学,(株)ニデック等によるベンチャー企業JTECに厚生省が融資を行ない,TE時代に突入した。
産業技術総合研究所ティッシュエンジニアリング研究センター(尼崎,Tissue Engineering Research Center,以下TERC)は阪大,京大,東大および多くの民間企業ととに,ミレニアムプロジェクトおよび新エネルギー・産業技術開発機構(NEDO)プロジェクトに参加して,細胞・組織工学技術の基盤技術として幹細胞の分離解析技術,細胞培養技術,細胞担体技術の開発を行ない,さらにそれらの技術を用いて骨,軟骨,心筋,血管,神経,皮膚の再生技術の開発に従事してきた。これらは現在行なわれている再生医療技術の中心的なものであり,2010年までに大規模な実用化が期待されている。以下にプロジェクトを通して明確になった産業化への見通しを基盤技術ごとに展望する。
体性幹細胞・前駆細胞の分離・増殖技術の開発
分離・解析技術の開発幹細胞分離技術に必要な要素技術の実用化について述べると,間葉系幹細胞の無血清培養法は実用化にきわめて近い開発段階にあると言える。無血清培養技術の確立により,新規成体多能性幹細胞の分離に関する研究は急速に進展することが考えられ,株化の達成も期待できる。これらの状況から,2005年には成体多能性幹細胞の大量培養法の確立も可能と言え,それ以降,成体多能性幹細胞デバイスから誘導された組織特異的幹細胞の前臨床試験の実施に移行できるものと考えられる。
さらに先駆的な分離法として遺伝子マーカーを用いた技術が期待されるが,現状ではマーカーの種類に限界があり,細胞の性質の多様性に対応しておらず,さらなる技術開発が必要な段階と言える。しかし,DNAマイクロアレイや,それに代わる新規技術を用いた研究等の進展により,多くのマーカー遺伝子が発見される可能性は高い。
分化誘導・幹細胞増殖技術の開発
神経系再生に関する実用化の見通しを述べると,神経幹細胞の培養はヒト胎児由来神経幹細胞については,大量培養技術の開発を行なっており,2002年までに技術的な問題は解決されると考えられる。しかし,社会的な配慮から,ヒト胎児由来神経幹細胞の実用化には時間がかかると考えられる。近年の研究開発により,廃棄物として処理されている胎盤や臍帯血から神経細胞に分化する幹細胞が分離される可能性はきわめて高く,実用化しうる細胞ソースとして期待されている。他方,末梢神経再生デバイスに関しては,動物による神経再生効果の確認,ヒトでの臨床試験を経た後,2005年には承認,実用化を達成できる可能性はきわめて高い。
骨格組織系の幹細胞およびマーカー分子に関する実用化の見通しについては,特に歯槽骨再生に関わる幹細胞デバイスの実用化に期待が持てる。すでに骨形成材料の開発はほぼ確立されている段階にあり,大型動物を用いた前臨床試験,臨床試験を経て,2007年上市を達成できる可能性は高い。
細胞組織化技術の開発
人工細胞外マトリックス神経分化用細胞外マトリックスに含まれる生理活性物質の分子実体の探求を行なっており,これが明らかになれば,まずは研究用試薬,次に組織細胞工学デバイス開発用マトリックス,さらに,神経再生用の医薬品へと発展する可能性がある。
コラーゲンスポンジに繊維芽細胞増殖因子をイオン間相互作用で固定化した人工細胞外マトリックスは,マウスで効率よく脂肪組織を誘導できることを明らかにした。また,得られた基礎的知見は,脂肪組織のみにとどまらず,多くの生体組織の再生にも適用でき,再生医療を実現していくためには必要不可欠な支援技術であると考えている。
未分化肝細胞を成熟させる環境については,将来的には手術検体からのヒト肝幹細胞分離も可能であると考えられ,人工肝臓や細胞移植治療などへの応用が可能になると思われる。
細胞外マトリックス
高速スクリーニング機器
(1)イメージング表面プラスモン共鳴測定装置が試作されており,この機器の汎用性は比較的高いため,理化学研究機器として市販できると考える。
(2)走査型近接場光学顕微鏡用に開発された表面分光分析装置には,汎用性があり,生体関連物質の表面分析の実績を積み重ね,その有用性を実証することにより,今後の細胞工学,材料表面化学,バイオマテリアル全般の研究に活用される。
骨・軟骨
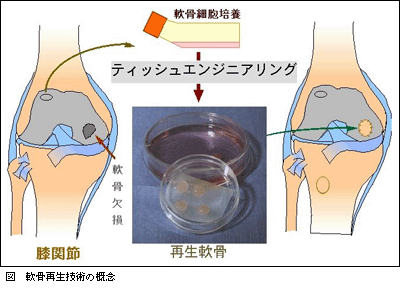
培養骨については,多孔質セラミックを担体とするハイブリッド人工骨および人工関節表面の培養骨細胞による表面修飾が実用化段階に入り,数例の臨床応用に成功した(図)。採取した患者の骨髄細胞をセルプロセッシングセンターで上記担体を用いて増殖させ,骨形成を行なう技術は確立している。これにより,患者,医療機関および許認可機関等を含む環境が整備されれば企業化は十分に可能である。一方,培養軟骨については第一世代の軟骨細胞移植に関する細胞増殖技術は既に企業化されている。コラーゲンゲルを担体とする軟骨細胞複合体は第2世代に属し,一部臨床応用されているが,これらの培養軟骨は必ずしも硝子軟骨になっておらず,関節軟骨としての性能を維持するに至っていない。現在ミレニアムプロジェクトで推進している培養軟骨は第3世代に属するもので,セルソースとして体性軟骨細胞のほかに,骨髄細胞中に存在する間葉系幹細胞から分化誘導した軟骨細胞も対象とし,生体外で軟骨組織形成を達成することを目標としている。現在,軟骨細胞が脱分化することを防止する技術が確立しつつあり,また大動物(ヤギ)に対する実験モデルも完成しつつあり,第一,第2世代に比較し,より完成度の高い関節軟骨が得られているので,臨床実験に入れる段階に到達している。
循環器
細胞機能化技術の開発に関しては,フィブロネクチンの自己会合ドメイン(フィブロネクチンが細胞表面で重合して,線維を形成するために必要なドメイン)とEGFのような増殖因子を組み合わせたキメラタンパク質を作製し,これが本来の増殖因子の活性を保持しつつ,フィブロネクチンと同じように細胞外マトリックスに不溶化されることが明らかになった。このようなマトリックス組込型の増殖因子は,拡散性の増殖因子単独と比較して,創傷治癒を促進する活性が有意に亢進する。
近年,マスコミ等で盛んに取り上げられている再生医療や細胞組織工学においては,さまざまな細胞や組織に分化しうる胚性幹細胞(ES細胞)を生体外や生体内で増殖・分化させ,機能不全に陥っている組織・器官を再生させるというのが基本コンセプトである。しかし,ES細胞を望み通りの細胞に分化させるためには,まだまだ多くの技術的な問題を解決する必要がある。また,各組織にも自己再生能と分化能を保持した幹細胞(組織幹細胞)が存在しており,これらを生体組織から取り出し,生体外で自由に増殖・分化させることも,ES細胞の操作技術と同様,重要な課題である。
疾患組織・臓器の代用となるインプラント型デバイスを開発に関しては,脱細胞化により作成された組織骨格(scaffold)のみの弁に,自己の平滑筋細胞や血管内皮細胞の前駆細胞をハイブリッド化(複合化)することが可能になった。これにより,移植直後の血栓形成を抑制しながら,血管構成組織の再生を誘導して,生体弁と同等の機能構造を獲得し,従来の材料では得られない半永久的使用可能な組織工学弁の開発に必要な技術が開発されている。
■今後の展開-再生医療の標準化戦略
体性幹細胞・前駆細胞の分離・増殖技術
ITとバイオの最大の違いは,商品開発までに要する時間である。競争力のない標的を目標とした研究・開発では投資を回収することは難しい。再生医療も他の医薬品同様に,10年近い開発期間がかかると一般に考えられている。現時点で必要なのは,「再生医療の標準化戦略」であり,新薬黄金時代が到来すると予想される2010年に上市を目標とする。再生医療の標準化とは,再生医療のターゲットするすべての組織を1つの幹細胞を用いて治療することであり,これにより再生医療のコスト・ダウンが可能となる。成体多能性幹細胞の効率的な分離・培養技術に関するプラットホーム技術を世界に先駆けて確立することが,現時点での研究開発の成敗を決定する。これにより,臓器移植,組織移植等に対する医療費抑制を可能とする,細胞組織工学を基礎としたヒト組織の再生技術と,そのための基礎的技術を早急に確立させ,再生医療用製品生産に関わる産業の発展を促進させることが可能となる。
骨・軟骨の構築技術
培養骨a.ヒト骨髄細胞中の間葉系幹細胞から骨芽細胞を分化・誘導し,リン酸カルシウムまたは水酸アパタイト多孔質体を細胞担体として生体外で培養して骨類似体を作製した後,体内に移植する動物モデルが,TERCおよび旭光学,オリンパス光学の共同研究で完成しており,臨床応用は近い。
b.コラーゲン・水酸アパタイト・リン酸カルシウムマイクロビーズを担体とし,培養骨芽細胞とともに骨中にインジェクションするタイプの骨再生は,TERCとアドバンスで動物実験が行なわれ,2-3年中に臨床応用可能である。
c.セラミック人工関節や多孔質表面を有する金属またはセラミック内固定器具の表面に骨芽細胞を増殖させ体内にインプラントする骨再生技術は,TERCによって実用化され,今後独立したCPCによる企業経営が行なわれるであろう。
軟骨
軟骨細胞移植は既に企業化している。コラーゲンゲルに埋入した軟骨細胞移植は臨床実験が実施済みであるが,両者ともにネガティブな結果も報告されており,しっかりした動物モデルの裏づけが必要である。
循環器構築技術
分離された心筋細胞の発生,分化,増殖,生存維持に関わる遺伝子および抗原抑制遺伝子をヒト幹細胞に低侵襲・高効率に遺伝子導入できるベクターを確立し,心筋細胞への分化誘導を促進するとともに,免疫寛容を獲得した心筋細胞の開発が実現する。さらに,細胞機能化技術の開発に関してはラミニンやフィブロネクチンをモデルとして,細胞外マトリックスの接着タンパク質の構造と機能を確立し,人工的な細胞外マトリックスを利用して細胞の増殖・分化を人為的に制御する新しい技術を開発し,組織再生が行なわれる。これは,構造・性質のまったく異なる2種類の成長因子をコラーゲン結合性に改良でき,ほとんどの成長因子に適用可能な技術として,将来の商業化が有望な技術である。
