免疫グロブリン遺伝子100万塩基対の解読
 清水信義氏(慶應義塾大学医学部教授 分子生物学・遺伝子医学)インタビュー
清水信義氏(慶應義塾大学医学部教授 分子生物学・遺伝子医学)インタビュー
Bリンパ球が抗原刺激を受けて作り出す抗体免疫グロブリンは,体内に侵入した異物に結合しそれを中和する。つまり,外敵から身を守る生体防御の中心的な役割を果たす分子である。
今回,清水信義氏らのグループが,免疫グロブリンの機能の鍵となる部分の遺伝子解読に世界ではじめて成功した。
解読されたのは,免疫グロブリンの2種類あるL鎖のλと呼ばれる部分で,塩基数約100万,遺伝子解読としては世界最長のものである。
本紙では,清水氏にインタビューを試み,その成功の背景や,遺伝子解読によりもたらされる新しいサイエンス,臨床への応用など,多岐にわたる話を頂戴した。


免疫グロブリンの遺伝子クラスター
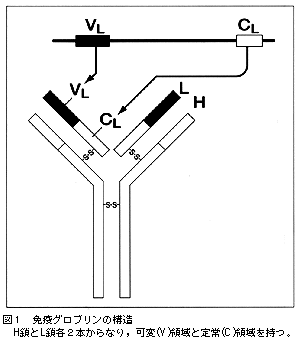
清水 人の免疫系,つまり生体防御システムには液性免疫と細胞性免疫があり,液性免疫はBリンパ球が作り出す抗体で,血液中の外敵を撃退します。一方,細胞性免疫はTリンパ球が主役です。今回われわれが解析に成功したのは,Bリンパ球が抗原刺激によって抗体を産生する時に,その抗体を作り出す元となる遺伝子で,クラスター(一群)になっています。Bリンパ球の抗体はH鎖(heavy chain)とL鎖(light chain)からできています(図1)。H鎖も1つの遺伝子クラスターで,L鎖はλとκと2群に分かれていて,われわれが解析したのはλの遺伝子クラスターです。λの遺伝子クラスターは,ヒトの染色体の22番上にあり,この染色体は,紐状のDNA分子の長さからいうと約50メガベース,5000万塩基対です。Igλの遺伝子クラスターは約100万塩基対ですから,今回は,22番染色体のDNAの,1/50に相当する部分を解析したことになります。
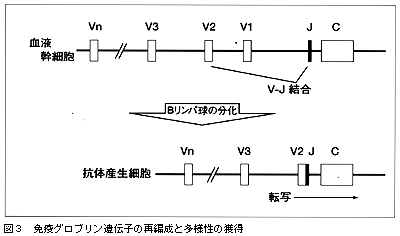
多様性の獲得
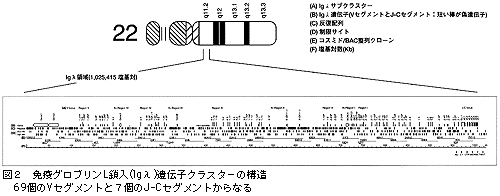
無限に近い抗原に対し,特異的な抗体免疫グロブリンを作っていくという基本的なメカニズムは,利根川進先生(マサチューセッツ工科大)をはじめ多くの免疫学者が,「多様性の獲得」という考え方を打ち出してきました。しかし,その実体となる遺伝子,つまり変貌を遂げる前の原型をとらえたということでは,今回が初めてのことなのです。λの遺伝子クラスター100万塩基対のAGCTの配列のなかで,いわゆるIgλの可変領域(Variable region)として69個のVセグメント,定常領域(Constant region)として7個のJ‐Cセグメントが発見されました(図2,A列)。ところが,塩基配列をきちっと決めて構造を個別に見てみると,69個のうちの36個だけが機能している完全な遺伝子の形をとっていて,残りの33個はいわゆる偽遺伝子(pseudogene)であることがわかりました。ですから,36個のVセグメントと7個のJ‐Cセグメントの組み合わせで原型ができているのです。それが抗原刺激を受ける間に,DNA再編成と体細胞突然変異を繰り返して,よりアフィニティの強い抗体を作るように変化していくのです(図3)。
可変領域の遺伝子数が36個というのは,すごく少ない気がします。しかし,メカニズム的に考えれば,抗体のレパートリーはすでに言われている「遺伝子再編成」のやり方で十分多様性を獲得するという感じはあります。
厳密な意味では,分子メカニズムは十分わかっていないけれど,リンパ球が分化を繰り返していく中で変貌を遂げていく微細な分子メカニズムを解析するツールが新たにできたということも言えます。
解読の方法
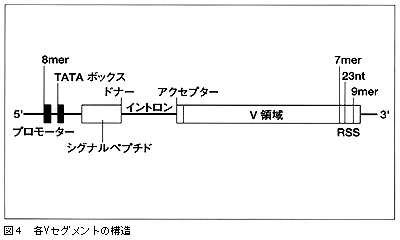
方法としては,未分化のBリンパ球前駆細胞からDNAを採取し,それをコスミド,あるいはBAC バックと呼ばれるベクターに組み込み,そのライブラリーからIgλのクラスターに相当する領域,100万塩基対に対応するDNA断片を整列させて,個別に塩基配列の決定を行ない,接続していきました(図2,E列)。そして一見無意味に見える100万のAGCTの並びに,句読点を打ったわけです。これは,コンピュータ・サイエンスと分子遺伝学の技術と情報の蓄積の両方によるものです。塩基配列の解析を進めていくと,基本的にはプロモーターがあり,TATAボックス,シグナルペプチド,スプライスサイトがあってV領域がある(図4)。さらにリコンビネーションを起こすためのシグナル(RSS)とか。これが機能しているはずの遺伝子の構造で,塩基配列が少しでも欠けている,微妙におかしいというのが偽遺伝子です。それはAGCTの配列が完璧にわかっていなければ言えないことだったので,これではっきりしました。
100万塩基対の中に,偽遺伝子も含めて70個近く並んでいますが,ここから様々なことが考えられるのです。例えば巨大なクラスターは5つのサブクラスターから成っており,その頭に定常領域の遺伝子が並んでいることもそうです(図2,A列)。
臨床への応用・新しいサイエンスの可能性
自己免疫疾患
人間の病気の中で,自己免疫疾患のように,自分の体内のタンパクに対して抗体を作ってしまうという問題があります。あるいは外来性のウイルス感染に対する抗体による防御というときに,どのVセグメントがどういうウイルス成分に対応してるかという問題もあります。今回の遺伝子解析により,このような問いに対する答えがどんどん出てきますし,カタログが作られるようになると思うのです。人工抗体作製の出発点
免疫グロブリンをつくる元になる遺伝子を,DNA断片としてクローン化していますので,例えば大腸菌のなかでいくらでも増幅することができます。それを用いて近い将来に,人工抗体をin vitroで作るための出発材料にしたいと考えています。in vitroで人工抗体の原型を作り,突然変異を起こさせ,それを大腸菌やイーストに発現させて,バラエティに富んだ抗体の分子を人工的に大量生産してしまうことも,もう夢ではないのです。イムノジーン法による遺伝子治療の可能性
遺伝子解読により,ある種の癌の遺伝子治療が可能となります。事実,われわれのところでは,別のプロジェクトで,「イムノジーン法」という遺伝子導入システムを開発しました。それは,細胞表面のレセプターを標的とするモノクローナル抗体に,ポリリジンというプラスチャージを持ったポリマーをつなげます。すると遺伝子は混ぜるだけで結合します。抗体としてはもともと細胞表面のレセプターを標的とする抗体を使うので,そのレセプターに結合した後,さらに遺伝子を細胞のなかに送り込むというシステムです。そうすると,人間の身体のなかの癌細胞を抗体でターゲットして,それに目的の遺伝子を入れることができるのです。現在,治療用の遺伝子を癌細胞に導入することを開発しています。先ほどの人工抗体も遺伝子のデリバリーシステムに応用するというストーリーにつながっているのです。
いまのところイムノジーン法は,ヌードマウスにヒトの扁平上皮癌を作らせて,その扁平上皮癌のEGF(epidermal growth factor:上皮増殖因子)レセプターをターゲットするモノクローナル抗体でTK(チミジンキナーゼ)遺伝子を導入しています。その後,プロドラッグと言われるガンシクロビルを静注あるいは腹腔内に入れると,ガンシクロビルがTKによってリン酸化を受け,癌細胞のDNA合成に利用され複製が乱されて,ターゲットされた癌細胞が死んでしまうという実験的癌治療に,ごく最近成功したのです。現在,イムノジーンによる遺伝子治療の臨床応用を,期待しているところなのです。今回,抗体の遺伝子クラスターや構造をただ決めたということだけではなく,臨床への応用という意味で,このような治療技術の開発を進めているのです。
先ほど述べたように,免疫グロブリンが無限の多様性を獲得するためには,体細胞レベルでの突然変異が導入されるような分子機構があると言われています。実際にリコンビネーション――組み換えは起こっていますし,リコンビネーション・シグナル(RSS)というのが事実あります(図4)。しかし,細かいメカニズムになるとまだまだ未解明です。
結果としては,抗原をいちばん強く中和する抗体分子を利用するかたちで,免疫の応答が完成するのですが,それも細胞と分子のからみで闘っていて,まだまだわからないことが一杯だと思います。しかし今回,そういうことを検証するツールが確かにできました。どれか1つのVセグメント,つまり原型に注目して,それがどのように変貌していくかを追跡するのは不可能ではなくなったのです。
あくまでも塩基配列は一次情報で,そこからできてくるタンパク質は二次構造,三次構造をとっています。それも,実際には個別の遺伝子を何十個と捕まえているのですから,それを発現させて,抗体タンパクを作っていくことができます。その時に,1個とか2, 3個のアミノ酸が違うだけで,抗原に対する結合性がどんどん変わっていくのです。そういう抗原と抗体の,タンパク質レベルでのインタラクションを調べるというサイエンスもこれから飛躍的に進むでしょう。
これは,コンピュータ・サイエンスと分子生物学を駆使した結果によるものです。ある程度,構造学的な情報が集まってくると,今度はその情報をコンピュータにデータベース化して,それで未知のタンパクあるいは機能のプレディクション(予測)もできるようになる。学問としてもそういう変貌をしていくと思います。
免疫現象とは無関係の遺伝子の存在
面白いのは,免疫グロブリンの遺伝子クラスターのなかに,免疫グロブリンあるいは免疫現象とは無関係にみえる遺伝子も間に割り込んでいることです(図2,B列)。無関係というか,関係がはっきりわからない5個の遺伝子が飛び込んでいます。また,クラスターの上流にまったく新しい2個の遺伝子が見つかっています。この長い領域のなかに,AluやL1などの反復配列がいろいろと意味ありげに分布しています(図2,C列)。例えば,総数372個のうち1/3くらいがサブクラスターの間のスペースのところに連続して入っています。ゲノムシークエンスを行なうことにより,cDNAのシークエンシングと比べて,遺伝子のエキソン,イントロン,調節領域,そして遺伝子間のスペースや塩基配列,それらのすべてを含めた構造が,初めて明らかになってきました。遺伝暗号以外にゲノム暗号も
遺伝子解析を行なう際,いわゆる遺伝暗号の解読がこれまで主流でした。遺伝暗号とは,タンパク質を作り出す暗号としての塩基配列のことです。しかし,これからは遺伝暗号以外の塩基配列,すなわちゲノム暗号の解読をする時代だと思っています。これは必ず意味がある。タンパク質を作る暗号ではないけれど,染色体の構築や維持に不可欠な情報もあろうし,遺伝子の発現をDNAの三次構造的な変換によって調節するための信号かもしれないのです。さらに子が親に似るという遺伝の根本を決めている情報が秘められているかもしれない。そういう新しいゲノム暗号の解読によって,ヒトという生物のブループリントが明らかになり,新しいゲノムサイエンスが進展するだろうと思われます。
新しい分子進化論
いままで,分子進化とはある1つのタンパク質,あるいはそれに対応する遺伝子をとらえて,ヒトとサルや,その他の動物,あるいはもっと下等な生物の種を比べながら分子の系統樹をたてて,分子進化を論じてきたわけです。ところが,免疫グロブリン遺伝子クラスターが作り出すものは抗体という分子で,その遺伝子は複数ありますが微妙に違っています。おそらく最初に1個,原型となる遺伝子があり,それが重複によって数を増やしながら少しずつ塩基配列を変えていき,バリエーションを増やしてきたと考えられます。そのような人間という生物種のなかでの1個の遺伝子の進化を考えることができるようになりました。それがクラスターや遺伝子ファミリーだから,そのなかでの進化を考えることができるのです。
機能する遺伝子と偽遺伝子の両方を合わせて69個で,それらをお互いに塩基配列,あるいはアミノ酸配列に置き換えて比較すると,似てる・似てないが判定できます。そして同じ1つのファミリーという言い方ではなく,クラン(族)という分け方ができるのです。
今回,抗体遺伝子の1つの原型が決まったわけですが,今後は個人差もここから解析できるわけです,それと同時に人種の差もです。われわれが提示した100万塩基対のAGCTを標準にして,人種間でどれぐらい違っているのかということを,国際的に多くの研究者が進めてくれると思っています。
最後に,このような大規摸シーケンシングを貫徹できたのは教室のDNAシーケンシングチームの熱意と努力の賜物であります。特に川崎和彦,工藤純,蓑島伸生君らのリーダーシップに敬意を表します。また,科学技術振興事業団の支援に感謝いたします。
発表論文
Kawasaki, K. et al.: One-Megabase Sequence Analysis of the Human Immunoglobulinλ Gene Locus, Genome Research, 7:250-261, 1997