〔連載〕How to make
クリニカル・エビデンス
-その仮説をいかに証明するか?-
浦島充佳(東京慈恵会医科大学 臨床研究開発室)〔第19回〕ストップ・ザ・狂牛病(3)
脚気細菌学説の論点
「脚気患者よりある細菌を分離し,これを動物に接種したところ,脚気様症状がみられ,これらの小動物の血液中にも同様の細菌を発見した」ことが「脚気細菌病学説」(本連載第1-13回参照)の根拠でした。しかし,これを支持する疫学的根拠は示されていません。現在の狂牛病に関しても,類似の論拠がまかり通っています。すなわち,「狂牛病の牛脳組織を人型プリオンを持つトランスジェニック・マウスに食べさせたところプリオン病の脳病理を呈した」ことにより「狂牛病食肉摂取がvCJD(変異型クロイツフェルト・ヤコブ病)発症の原因である」とされているのです。このように,実験研究においては狂牛病とvCJDの因果関係を示唆するデータが示されたのですが,疫学的エビデンスがほとんどないのが現状です。もう1度,2つの病気をつないでいる根拠を検証してみることにしましょう。
vCJDにみられた異常プリオンの分子生物学的解析
正常プリオンは神経細胞のアポトーシスを抑制していると考えられています。そのため正常プリオンが異常プリオンにとって変わられてしまうと,神経細胞がどんどん脱落してしまうために,脳の中がスポンジのように穴の空いた状態となってしまうのです。そうすると,人格が変わってしまったり,歩けなくなったり,最後は常時,看護を必要とする状態に至り死亡します。異常プリオンは正常プリオンに付着することにより,この正常プリオンを異常プリオンに変えます。この反応が進めば,正常プリオンは次々と異常プリオンに置き換えられていくことになります。そして,プラークと呼ばれる不溶性蛋白塊を脳組織内に形成します。
このことを利用して,人型プリオンのみを脳内に発現するマウスを遺伝子操作により人工的に作り上げ,狂牛病の脳組織を食べさせました。もしも狂牛病異常プリオン摂取がvCJDの原因であれば,狂牛病異常プリオンはマウス脳組織で人型正常プリオンにくっつき,これを次々と異常プリオンに変え,脳をスポンジ状に変えるはずです。
興味深いことに,従来型のCJD(クロイツフェルト・ヤコブ病)は人型プリオンには非常に高い親和性を持ちますが,マウスのそれにはくっつきません。
一方,vCJDと狂牛病は人型プリオンにもマウス型プリオンにもよくくっついてプラークを形成します。つまり,vCJDと狂牛病のプリオンは種を超えて感染し得ることを示しています(表)。

異常プリオンは,蛋白融解酵素によって分解されきらない特性があります。これを逆手にとる,すなわち蛋白融解酵素に分解されなければ異常プリオンとみなすことができます。通常のCJDでは蛋白融解酵素処理後,脳組織をウエスタンブロット分析(蛋白質を解析するための電気泳動法)すると,3本のバンドが検出されます。CJDでは,運動失調と精神症状で発症するタイプ,痴呆で発症するタイプ,そして硬膜移植など医療行為によって発症するタイプがありますが,それぞれは類似していながらも微妙にバンドの位置がずれていました。
そして,vCJDはこれら3タイプとさらに異なっていたのです。このことは「若年発症のvCJDは従来のCJDと異なる病因を持つ」可能性を示唆しています。この結論に関して異論はないでしょう。
この3本のバンドパターンの違う要因として,この研究論文の著者らは,糖のつき具合の違いに着目しています。旧来型のCJDおよび医源性CJDでは,2番目のバンドに糖が多くついているのですが,vCJDでは1番目のバンドに糖が最も多くついていました。そして,それぞれの型のCJDおよび狂牛病脳組織をマウスに食べさせたところ,糖のつき具合に関して狂牛病のものとvCJDのものが類似していたのです。また,結果は示されていませんでしたが,狂牛病の脳を牛の異常プリオンに反応する抗体で直接調べたところ,同様の糖のつき具合だったようです。これらのエビデンスをもって,著者らは狂牛病がvCJDの原因であると結論づけています(Nature 1996; 383: 685-90)。
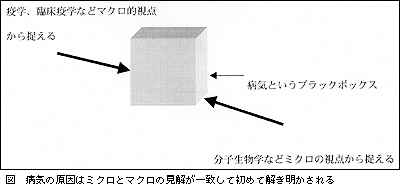
もちろん,狂牛病の食肉と健康な牛の食肉を,2群の人々にランダムに食べさせてダブルブラインドの状態で比較すれば直接的証明になりますが,これを行なうことは倫理的に許されません。かといって,動物実験の結果だけでは論拠に薄く,やはり疫学的エビデンスが2つの病気を結びつけるためにどうしても必要です(図)。しかし,いまだに決定的なものはありません。