| ●東大病院内科研修医セミナー | |||
第1回テーマ
本連載では,東大病院で内科研修医を対象に月2~3回,昼の1時間を使って行われている内科グランドカンファレンスを紹介します。各診療科での実際の症例を通して,疾患の診断・治療に関する生きた知識を吸収していただければ幸いです。
■CASE【症例】 35歳,男性。【主訴】 足のむくみ。 【現病歴】 2002年の検診まで異常を指摘されたことがなかった。2003年の検診で蛋白尿を初めて指摘され,2004年5月より足の浮腫を自覚したため,前医を受診した。ネフローゼ症候群と診断され,原因精査のために腎生検が行われた。その結果,ALアミロイドーシスと診断され,治療目的で当院に入院となった。 【身体所見】 血圧:102/60mmHg(臥位)→80/70mmHg(立位),脈拍:100/分(臥位)→105/分(立位),心雑音,III音,IV音を聴取しない。肝を季肋下3cm触知する。両側足背・下腿にpitting edemaを認める。
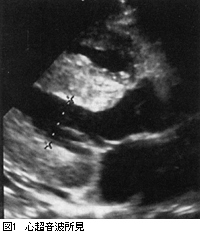
生化学:総蛋白4.2g/dl,アルブミン1.7g/dl,コリンエステラーゼ486IU/l,クレアチニン0.79mg/dl,尿素窒素15.9mg/dl,総コレステロール412mg/dl,アルカリフォスファターゼ 300IU/l,γGTP90IU/l,AST27IU/l,ALT28IU/l,IgG1,010mg/dl,IgA44mg/dl,IgM70mg/dl,脳ナトリウム利尿ペプチド(BNP) 66.2pg/ml,β2ミクログロブリン2.7μg/ml,血清M蛋白(IgGλ)陽性。 尿検査:蛋白尿:尿蛋白(3+),1日尿蛋白:8 g,クレアチニンクリアランス 120ml/分,尿中Bence-Jones蛋白(λ)陽性。 胸部X線所見:CTR 47%,胸水貯留は認めない。 心電図:低電位(RV5+SV1=0.50mV),PR間隔226ms,III,aVFにST低下を認める。 心超音波検査:%FS32,EF0.61,心室中隔(IVS)厚14 mm,心室壁は高輝度エコーを示す(図1)。 骨髄検査所見:形質細胞8.5%。
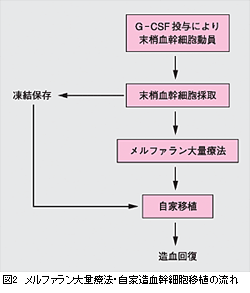
入院後,アミロイドーシスによる臓器障害の把握のための各種検査が行われた。 腎:蛋白尿(1日約10 g)がみられるが,クレアチニンクリアランスは正常範囲内。 以上より,ALアミロイドーシスによる臓器障害をきたしているが,メルファラン大量療法を行える臓器機能の基準は満たしていると判断された。今後,G-CSF投与による末梢血造血幹細胞動員・採取の後,メルファラン大量療法・自家造血幹細胞移植(図2)を予定している。
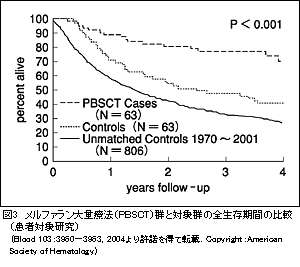
■REVIEWALアミロイドーシスとはアミロイド物質が各臓器組織の細胞外に沈着し,さまざまな臓器障害をきたす疾患群がアミロイドーシスである。生検組織のhematoxylin-eosin (HE)染色で硝子様物質を認め,コンゴーレッド染色陽性となる。アミロイドーシスは,いくつかの異なるアミロイド前駆体によって起こりうるが,ALアミロイドーシスは,免疫グロブリン軽鎖を前駆体としてALアミロイドが沈着して起こるものである。これは,異常形質細胞のクローン性増殖による,いわゆる形質細胞増殖性疾患(plasma cell dyscrasia)の一種である。本症は従来,原発性アミロイドーシスと呼ばれたものと同じもので,多発性骨髄腫に合併して起こることもあるが,溶骨病変がないなど骨髄腫の診断基準を満たさない場合のほうが多い。アミロイドーシスの診断と臨床像ALアミロイドーシスによって起こる臓器障害は進行性で,無治療の場合の予後は,中央値13カ月と予後不良である。起こりうる臓器障害の代表的なものは,ネフローゼ症候群,肝腫大,拘束性心筋障害,末梢神経障害などである。これらの原因が不明であった場合,免疫固定法,免疫電気泳動などによりM蛋白の有無をみておくことが勧められる。M蛋白が認められた場合には,骨髄生検や,皮下脂肪組織を含む組織の吸引細胞診・生検によって診断をつめることができる。凝固障害による出血傾向を伴うことがあり,深部組織および消化管の生検適応の決定は慎重に行うべきである。心病変:拘束型心筋障害をきたす。心超音波検査にて心室壁肥厚,拡張障害の所見がみられた場合に疑われる。さらに,壁内の高輝度エコーが特徴的所見として知られる。症状を伴う心アミロイドーシス合併例では,診断からの生存期間は5カ月以下(中央値)と予後が非常に悪い。ALアミロイドーシスの患者の多くは心アミロイドーシスによるうっ血性心不全の進行,不整脈が原因となって死亡する。心トロポニン,N末端プロBNPがALアミロイドーシスの患者の予後を予測する重要なマーカーであることが最近認識されてきた。 腎病変:多発性骨髄腫による腎障害では主に尿細管障害をきたすのに対して,腎糸球体を主とするアミロイド沈着により,まずネフローゼ症候群をきたし,進行すると慢性腎不全にいたる。骨髄腫の患者で,蛋白尿の成分のほとんどがアルブミンである場合,アミロイド腎症を疑う。腎症と診断された患者の1/3が透析開始となり,それまでの期間は14カ月(中央値)とされる。 消化器病変:繰り返す下痢・便秘が消化管アミロイドーシスの特徴的な症状である。肝アミロイドーシスにより,肝腫大,アルカリフォスファターゼ値高値をきたす。 末梢神経病変:感覚障害,自律神経障害をきたす。自律神経障害と,ネフローゼ症候群による血管内容量の減少のため,コントロール不良な起立性低血圧をきたす。 ALアミロイドーシスに対する治療各臓器障害に対する支持療法を行いながら,アミロイド沈着のもととなるM蛋白を減少させ,続いて数カ月以上かけて臓器障害の改善を期待する,というのが基本的な治療の考え方である。アミロイドーシスに対する治療の有効性は,(1)血清中あるいは尿中のM蛋白量の減少・骨髄形質細胞の減少(血液学的奏効),(2)アミロイドーシスによる臓器障害の改善,(3)生存期間の延長に分けて評価される。今のところ,治癒を目指すのは困難と考えられる。まず,必要に応じて心・腎などの臓器障害に対する支持療法が行われる。例えば浮腫,心不全に対して利尿薬,起立性低血圧に対して昇圧薬などが用いられる。M蛋白を減少させる治療法としては,多発性骨髄腫に用いられてきた治療法が応用されている。MP(メルファラン,プレドニゾロン)療法は外来通院で可能な経口療法である。MP療法により血中M蛋白,アミロイド沈着が減少するだけでなく,臓器障害の改善,生存期間の延長が期待できる。コルヒチン療法,MP療法,コルヒチン併用MP療法の三者を比較した臨床試験では,M蛋白量の減少がそれぞれ2.8,28,28%にみられ,生存期間中央値はそれぞれ8.5,18,17カ月(p<0.001)で,MP療法による生存期間の延長が示されている。一方,この治療では血液学的奏効率が低いこと,臓器障害の改善に中央値で1年と長期間かかることが問題となる。デキサメタゾン大量療法や,これに化学療法を併用する治療法も用いられる。デキサメタゾン大量療法による寛解導入,デキサメタゾン大量療法・インターフェロンによる維持療法を含めた治療によって治療開始1年の時点で血液学的奏効が50%の患者に,臓器障害の改善が45%の患者にみられたと報告されている。MP療法より早く臓器障害改善がみられる可能性が示唆される。 ■TOPICSALアミロイドーシスに対するメルファラン大量療法メルファラン大量療法・自家造血幹細胞移植(以下,メルファラン大量療法)は,奏効率が高く,生存期間の延長が期待できる治療として期待されている。治療の流れは図2のとおりで,あらかじめ白血球,赤血球,血小板などの造血系細胞のもととなる患者自身の造血幹細胞を採取・凍結保存しておき,メルファラン大量療法後に輸注することによって,速やかな造血回復がもたらされるというものである。米国のBoston University Medical Centerからの報告では,同施設で診療を受けたアミロイドーシスの患者の約半数がメルファラン大量療法が可能な基準を満たしていた。このうち約9割で実際にメルファラン大量療法が行われたが,これらの患者では生存期間4.6年と予後が比較的良好であった。治療後1年の時点で生存していた患者のうち,血液学的完全奏効率40%で,これらの患者の66%に少なくとも1臓器の障害の改善がみられ,生存期間中央値は8年以上であった。一方,メルファラン大量療法を受けた患者の13%が移植後100日以内に死亡している。他の報告も同様で,この治療による死亡率の高さが問題となっている。本治療の対象患者の基準を明確にすること,臓器障害の強い患者では用量の減量を行うことなどによって治療成績が改善する可能性がある。一方,メルファラン大量療法後の予後が良好なのは,治療の効果ではなく,臓器機能を保った予後良好な患者を選択した結果に過ぎないのではないかという議論がある。患者対照研究によると,メルファラン大量療法群,対照群の4年全生存率はそれぞれ81,41%で,メルファラン大量療法のほうが予後が良いようである(図3)。現在,メルファラン大量療法・自家造血幹細胞移植とメルファラン・デキサメサゾン療法の成績を比べる無作為比較試験がフランスで進行中で,ALアミロイドーシスにおけるメルファラン大量療法の位置づけは今後さらにはっきりするかもしれない。
■理解を深めるために1) Merlini G,Bellotti V:Molecular mechanisms of amyloidosis. N Engl J Med 349:583-596, 2003(アミロイドーシスの発症の機序を知るのによい)2) Guidelines on the diagnosis and management of AL amyloidosis. Br J Haematol 125:681-700, 2004(ALアミロイドーシスに関する英国のガイドライン。この病気のマネジメントに関する知見がよくまとまっている) 3) Dispenzieri A, et al:Superior survival in primary systemic amyloidosis patients undergoing peripheral blood stem cell transplantation;A case-control study. Blood 103:3960-3963, 2004(メルファラン大量療法の有用性を示した患者対照試験の報告) |
 【一般検査所見】 血算:白血球6,300/μl,赤血球534×104/μl,ヘモグロビン16.9g/dl,ヘマトクリット51.7%,血小板40.9×104/μl。
【一般検査所見】 血算:白血球6,300/μl,赤血球534×104/μl,ヘモグロビン16.9g/dl,ヘマトクリット51.7%,血小板40.9×104/μl。
 【入院後経過】 腎生検によりALアミロイドーシスと診断された症例。骨X線では溶骨病変はなく,骨髄中の形質細胞は10%未満であり,多発性骨髄腫の診断基準は満たしていなかった。
【入院後経過】 腎生検によりALアミロイドーシスと診断された症例。骨X線では溶骨病変はなく,骨髄中の形質細胞は10%未満であり,多発性骨髄腫の診断基準は満たしていなかった。