中間解析と早期終了の問題点 その 1(植田真一郎)
連載
2010.08.02
論文解釈のピットフォール
【第17回】
中間解析と早期終了の問題点 その 1
植田真一郎(琉球大学大学院教授・臨床薬理学)
(前回からつづく)
ランダム化臨床試験は,本来内的妥当性の高い結果を提供できるはずですが,実に多くのバイアスや交絡因子が適切に処理されていない,あるいは確信犯的に除 去されないままです。したがって解釈に際しては,“ 騙されないように” 読む必要があります。本連載では,治療介入に関する臨床研究の論文を「読み解き,使う」上での重要なポイントを解説します。
欧米で臨床試験を実施する際には,GCP(Good Clinical Practice)に基づいて独立データモニタリング委員会(あるいはデータ安全性モニタリング委員会)が設けられています。本連載第7回(2850号)で,日本と欧米では臨床試験の規制が異なるという話をしました。GCPとは治験実施に関する規制であり,日本では省令GCPと呼ばれています。欧米では,すべての臨床試験にGCPが適用されるので,本連載で取り上げた,日本で言う治験の範疇には入らない臨床試験においても,独立データモニタリング委員会が設けられています。
ただし,日本においても,最近は治験以外の多くの臨床試験で独立データモニタリング委員会が設置されているようです。この委員会の大きな役目は中間解析を行い,必要ならば試験の中止を勧告することです。これは,ヘルシンキ宣言にある「医師は,利益よりも潜在する危険が高いと判断される場合,または有効かつ利益のある結果の決定的証拠を得られた場合には,すべての実験を中止しなければならない」を実現するためです。
臨床試験の早期終了の理由にはいくつかあります。ヘルシンキ宣言にあるように,中間解析の結果試験薬が優れていることが明らかになった場合のほかに,重大な有害事象が生じて被験者保護のために中止すべきであると判断された場合や,試験をこれ以上継続しても試験薬の有効性を示すことができそうにない場合,さらに他の試験で何らかの結果が報告され現在の試験を継続する理由がなくなった場合などがあり得ます。実例を挙げると,カナダの心房細動患者におけるワルファリンの臨床試験は,試験実施期間中にワルファリンの有効性を示す複数の臨床試験の結果が報告されたため中止となりました1)。
臨床試験の早期終了の本来の目的は研究費を節約することでも,劇的な効果をいち早く報告することでもなく,あくまで被験者を保護することにあります。しかし,問題も多いのが実情です。動脈硬化性疾患の臨床試験はだいたい5年間の観察を行いますが,疾患の時間的な経過を考えると短すぎるという批判を受けることがあります。もし5年の観察期間を予定していた試験で3年後の中間解析で中止を考慮する基準(後述)を満たし,中止となったとき,「劇的な効果があり,早期終了となった。すごい薬だ!」と考えてよいのでしょうか?
早期終了の動機
近年,早期終了して報告される研究は増加していると言われます。Montoriらの調査によると,1984年までは試験薬が有益であるという理由で早期終了された研究はほとんどありませんでした2)。その後徐々に増加したとは言え,2000年から2004年までの間にMEDLINEに掲載されたランダム化比較試験のうち,試験薬の有益性が中間解析で明らかになったことによる早期終了はわずか0.1%(71/58537)であるにもかかわらず,New England Journal of MedicineやLancetなどのTop impact journalだけに限って言えば1.2%(47/3859)が早期終了の論文なのです。すなわち早期終了した論文の多くは,おそらく試験薬の効果が劇的であることも理由となってTop impact journalに掲載されているのだと思います。
先述したように,中間解析や早期終了は本来,試験に参加した患者,あるいは試験で対象となった疾患を持つ患者のために行われるものです。しかし,製薬会社による研究が大半を占める現状と併せて考えると,そうとも言えない気がします。すなわち劇的な結果をより早くTop impact journalに報告すれば製薬会社の利益にもなり(研究費も節約できます),研究者の「野心」のようなものも満たせるという動機です。
有効性が明らかになったために早期終了した試験における試験薬の効果が劇的に見えるのには,もちろん理由があります。まず,臨床試験計画を作成するに当たり,中間解析後の試験中止に関する規則をあらかじめ決めておかなければなりません。試験終了時の解析でp<0.05であれば通常その試験薬は有効であるとされますが,中間解析ではより低いp値が求められます。表に示すように,さまざまな方法があります3)。
| 表 中間解析において試験終了を考慮するp値(文献3より改変) |
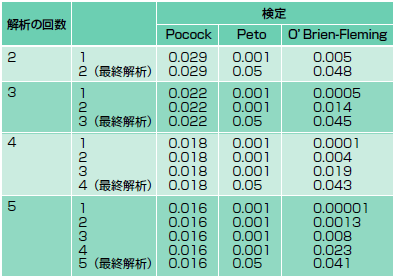 |
例えば,Peto検定では,中間解析を何回行ってもp<0.001を早期終了のBoundary(境界)としています4)。何度中間解析を行ったとしても早期終了をせずに試験が終了した場合,p<0.05であれば有意差があるとします。したがって,Peto検定で早期終了に至った試験の場合,試験薬と対照薬のエンドポイント発症リスクの差の検定におけるp値は少なくともp<0.001なのですから,p<0.05よりも劇的に見えるわけです。他の方法を用いると,最終的な解析において有効とするp値を低く設定することになりますが,中間解析に関してはそれほど差がなく,やはり早期終了したものの結果は劇的に見えますね。問題は,この「劇的な効果」が過大評価になっていないかどうかなのです。
JUPITER試験における早期終了
JUPITER試験は,LDLコレステロールが正常であるが血清CRPが高値である健常者(血清CRP値0.2 mg/dL以上)を対象として,ロスバスタチンとプラセボを比較した試験です4)。この論文の著者らは,CRPが独立した心血管イベントのサロゲートマーカーになると提唱しており,事実スタチン系薬剤の副次的解析では仮説を支持するような結果が得られています。また,Rossの提唱した動脈硬化の炎症仮説の視点からも興味が持たれる研究です。
一次エンドポイントは心筋梗塞,脳卒中,動脈血行再建術,不安定狭心症による入院,心血管死亡の複合です。この試験は,Event drivenすなわち一次エンドポイントが520例発生するまで試験を継続するようにデザインされています。結果として,2年足らずで早期終了となりました。図にカプランマイヤー曲線を示しますが,一次エンドポイントに関して相対リスク低下は44%と,これまでのスタチン系薬剤(25-30%程度の心筋梗塞リスク減少)の相対リスク低下と比較し,確かに“劇的”ですね(一次予防ですし,絶対リスク低下はたいしたことはありません)。
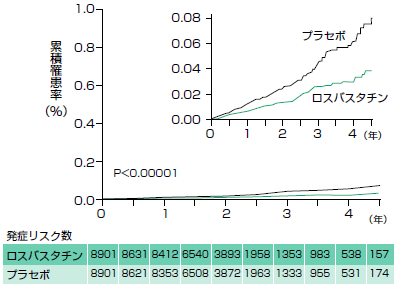 |
| 図 JUPITER試験における一次エンドポイントの発生と治療群間の差(文献5より改変) |
| 4年間の経過とされているが,実際の観察期間の中央値は1.9年。44%の相対リスクの低下(p<0.00001)が認められる。この試験では表のうちO'Brien-Flemingの基準を採用している。予定中間解析は2回で,初回の解析で試験終了となった。 |
さて,この結果は新たなスタチン系薬剤の適応を“強力に”示唆するものでしょうか? それとも早期終了により過大評価しているのか,次回考察してみましょう。
(つづく)
参考文献
1)Laupacis A, et al. How should results from completed studies influence ongoing clinical trials? The CAFA study experience. Ann Intern Med. 1991 ; 115(10) : 818-22.
2)Montori VM, et al. Randomized trials stopped early for benefit: a systematic review. JAMA. 2005 ; 294(17) : 2203-9.
3)Schulz KF, Grimes DA. Multiplicity in randomised trials II ; subgroup and interim analyses. Lancet. 2005 ; 365(9471) : 1591-95.
4)Peto R, et al. Design and analysis of randomized clinical trials requiring prolonged observation of each patient. I. Introduction and design. Br J Cancer. 1976 ; 34(6) : 585-612.
5)Ridker PM, et al; JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008 ; 359(21) : 2195-207.
いま話題の記事
-
忙しい研修医のためのAIツールを活用したタイパ・コスパ重視の文献検索・管理法
寄稿 2023.09.11
-
人工呼吸器の使いかた(2) 初期設定と人工呼吸器モード(大野博司)
連載 2010.11.08
-
連載 2010.09.06
-
事例で学ぶくすりの落とし穴
[第7回] 薬物血中濃度モニタリングのタイミング連載 2021.01.25
-
寄稿 2016.03.07
最新の記事
-
医学界新聞プラス
[第3回]人工骨頭術後ステム周囲骨折
『クリニカル・クエスチョンで考える外傷整形外科ケーススタディ』より連載 2024.04.19
-
医学界新聞プラス
[第2回]心理社会的プログラムを分類してみましょう
『心理社会的プログラムガイドブック』より連載 2024.04.19
-
医学界新聞プラス
[第1回]心理社会的プログラムと精神障害リハビリテーションはどこが違うのでしょうか
『心理社会的プログラムガイドブック』より連載 2024.04.12
-
医学界新聞プラス
[第2回]小児Monteggia骨折
『クリニカル・クエスチョンで考える外傷整形外科ケーススタディ』より連載 2024.04.12
-
医学界新聞プラス
[第5回]事例とエコー画像から病態を考えてみよう「腹部」
『フィジカルアセスメントに活かす 看護のためのはじめてのエコー』より連載 2024.04.12
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
