| ●東大病院内科研修医セミナー | ||
第13回テーマ
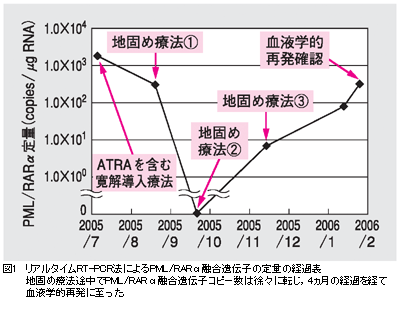
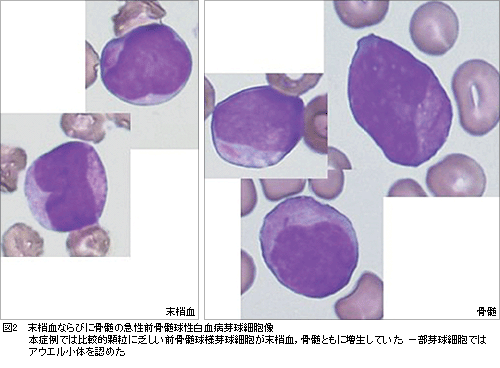
CASE【症例】 50歳,男性。【主訴】 特になし。 【現病歴】 2005年7月,発熱,紫斑認め,近医受診。白血球数3.34×104/μl (芽球47.5%,前骨髄球29.5%,骨髄球2.5%),骨髄穿刺検査にて前骨髄球が92%と増生,染色体検査にて46XY,t(15;17)(q22;q12),RT-PCR法にてPML/RARα融合遺伝子陽性を認め,急性前骨髄球性白血病(APL)と診断した。初診時,播種性血管内凝固症候群(DIC)も合併していた。寛解導入療法としてダウノルビシン50mg/m2day1-3,シタラビン100mg/m2day1-7に加え,オールトランス型レチノイン酸(ATRA,ベサノイド®)45mg/m2day6-45を投与し,血液学的完全寛解を得た。続いて8月から10月にかけて,地固め療法2コース((1)ダウノルビシン50mg/m2day1-3,シタラビン100mg/m2day1-7,(2)ミトキサントロン10mg/m2day1-3,シタラビン100mg/m2day1-7)施行し,血液学的完全寛解を持続していた。リアルタイムRT-PCR法によるPML/RARα融合遺伝子の定量的変化は図1の通りである。11月15日,3回目の地固め療法としてイダルビシン12mg/m2day1-3投与後,骨髄抑制が遷延化し,2006年1月13日施行した骨髄穿刺検査では芽球様細胞増生は明らかでなかったものの,リアルタイムRT-PCR法にてPML/RARα融合遺伝子の増加傾向を認め(図1),分子生物学的再発と診断した。さらに1月25日施行した骨髄穿刺検査にて前骨髄球増加が明らかとなり,血液学的再発と診断した。2月15日に再寛解導入療法目的で当科に紹介入院となった。
【既往歴】 30歳時:胃潰瘍,46歳時:大腸ポリープ,高尿酸血症,高脂血症,抑うつ。 【家族歴】 特記すべきことなし。 【身体所見】 入院時performance status (PS):0,身長162.1cm,体重77.95kg,意識清明, 血圧140/92mmHg,脈拍78/分・整。〔皮膚〕紫斑・出血斑あり。〔頭頸部〕眼瞼結膜に貧血あり,口腔内異常(白苔,口腔内潰瘍治癒瘢)。〔胸部〕心音:I →II →III (-)IV (-),雑音なし,呼吸音:正常。〔腹部〕平坦かつ柔軟,腫瘤を触れず,肝脾腎:触知せず,腸蠕動音:正常。〔四肢〕出血斑あり。〔神経学的所見〕下肢に痺れあり,位置覚,下肢腱反射減弱。〔リンパ節〕触知せず。 【入院時検査所見】【入院時検査所見】〔血算〕WBC 3.0×103/μl(Blast 4.0%,Pro 20.0%,My 1.0%,St 3.0%,Seg 41.0%,Eos 0.0%,Baso 0.0%,Mono 4.0%,Lym 27.0%),RBC 227×104/μl, Hb 7.8g/dl,Ht 23.2%,Plt 2.4×104/μl,Reticulocyte 2.2%
【入院時画像所見】〔胸部X線,腹部X線〕異常なし。〔頭部CT〕明らかな異常なし。〔頸部~骨盤CT〕感染巣なし,芽球肉腫認めず。〔心エコー検査〕EF 67%,特に異常認めず。 【入院画像所見】
【入院後経過】
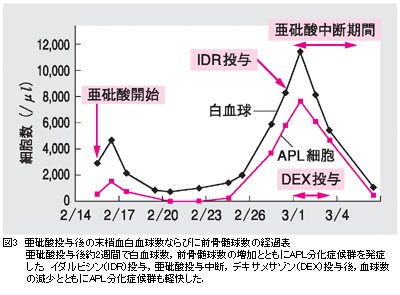
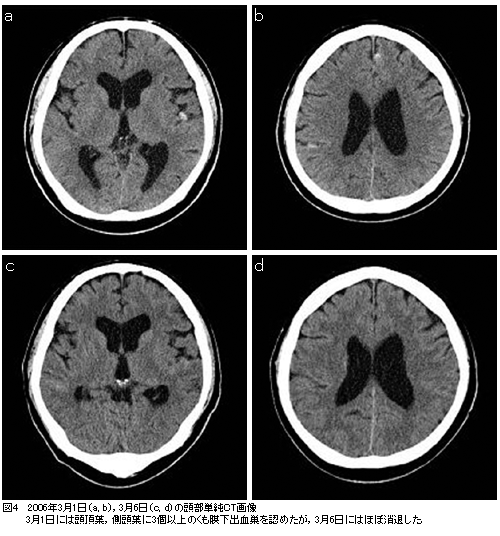
・3月1日,激しい頭痛を認めたため,頭部CTを撮影したところ,多発性(少なくとも3カ所に)くも膜下出血の像を呈していた。この時,血小板数3.5×104/μl,fibrinogen 407mg/dl,FDP 5.1μg/mlで明らかなDICの徴候はなかった。上述の通り,ATO中止し経過観察したが,3月6日,頭部CTにてくも膜下出血の消退傾向は明らかであり,頭痛も軽快したため,ATO投与を再開した(図4)。くも膜下出血の原因検索のためにMR アンギオグラフィー施行したが,脳動脈瘤や脳動脈奇形は認めなかった。DICを伴わないATOの副作用としてくも膜下出血の報告例はない。APLの中枢神経浸潤に伴って生じた出血である可能性も否定できないが,非典型的な画像であり,原因ははっきりとはしない。なお,髄液検査はこの時点で施行することを危険と判断し,行わなかった。 ・現在ATOを継続投与中で,骨髄抑制期に入っている。今後血液学的寛解から分子生物学的寛解を目標とし,目標に到達した場合には自家造血幹細胞移植を予定している。
(つづきは本誌をご覧ください) |