| ●SCOPE | |||||||
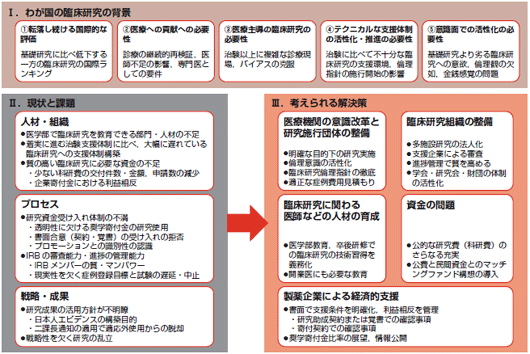
医療の質を高める臨床研究の実現を目指して 今村恭子(一般財団法人日本製薬医学会) ■臨床研究の資金はどこから来るのか?2009年12月5日,第30回日本臨床薬理学会のシンポジウム14「大規模臨床試験の基盤整備:ルール・ファンド・利益相反」にて,澤田らは心血管イベントを真のエンドポイントとして行われた被験者数300人以上の119臨床試験について,スポンサー(試験の実施者)を対象にしたアンケート調査の結果を発表した1).それによると,研究費の提供者としては「財団」が25試験(39.7%),「公的機関」が21試験(33.3%),製薬企業等の「私的機関」が13試験(20.6%),「自己調達」が10試験(15.9%)であった(「薬事日報」2009年12月9日朝刊より).一方,財団の資金源としては,回答があったすべての16試験が私的機関からの資金提供を受けており,実際には約半数の試験が製薬企業等の支援によって行われている実態が報告された. 昨今,研究者の利益相反が社会の注目を集めるようになり,研究の実施や成果の公表に際しては利益相反の申告が必要となってきている.さらに,厚生労働省告示で2009年に施行された「臨床研究に関する倫理指針」2)にある通り,優れた臨床研究は医療の質を高めるうえで重要な役割を果たすだけに,適切な試験の管理や人材育成が焦眉の急であることは言うまでもない. 今回,こうした臨床研究の現状と課題について製薬医学(Pharmaceutical Medicine)の観点から考察し,今後の改善策と期待をまとめた. ■製薬医学とは何か?1970年代に世界で最も早く製薬医学を卒後専門医教育課程として開講した英国内科医師会によると,製薬医学とは,創薬から研究・開発,薬事申請・承認,市販後の管理に至る全過程を網羅する学問であり,その実践には患者のベネフィットの最大化という視点に加えて,薬事法や各種指針を遵守した組織的な行動が求められる. 一般財団法人日本製薬医学会ことJAPhMed(Japanese Association of Pharmaceutical Medicine)では,その上位機関である国際製薬医学医師連合会(IFAPP:International Federation of Associations of Pharmaceutical Physicians)が定義したシラバスと共通カリキュラムに従った製薬医学の定期研修を2005年から開催しており,2008年からは認定医試験を実施している. 製薬関連業務に従事する産官学の医師による日本製薬医学会は,設立以来の約40年間,医薬品の有効性と安全性の評価や製薬企業内における医師の役割と重要性の啓発を強く推進してきた.1971年には,さらなる製薬医学の普及を目指してIFAPPに加盟している.会員は,主に海外に本社のある製薬企業をはじめとして,大学・行政機関,医療機関などに勤務する医師で構成され(2009年1月時点で222名),その多くは臨床研究の実務経験をもっている. ■「臨床研究に関する提言」について日本製薬医学会では臨床研究の推進に向けたさまざまな課題を明らかにし,その対応策を含めた具体的な提言を示したので紹介したい. 背景:下落しつつある国際的評価厚生労働省「臨床研究に関する倫理指針」では「近年の科学技術の進展に伴い,臨床研究の重要性は一段と増している」「最善であると認められた予防方法,診断方法及び治療方法であっても,その有効性,効率性,利便性及び質に関する臨床研究を通じて,絶えず再検証されなければならない」としている3).しかし,わが国の臨床医学研究の分野は近年衰退傾向にあり,2003年以降の国際的論文発表ランキングでみると,18位まで順位を落とした4).質の高い臨床研究の欠如と,それによるエビデンス構築の遅れは,医療水準の向上のために早急に解決されなければならない課題である. 趣旨:何が問題で,どうしたらよいのか?医学研究の中でも患者に対する介入研究を伴う臨床試験としては,製薬企業が行う承認申請を目的とした開発治験と,医師(研究者)が行う医師主導臨床試験がある.企業治験の場合,開発対象となる併用療法や適応疾患には限界があるため,医学や治療の進歩のためには医師主導臨床試験の必要性が近年ますます重要視されてきた.しかし,その一方で臨床研究体制には多くの不備が指摘されており,また研究者に対する教育機会も十分確立していない.臨床研究を行ううえでの運営資金も十分とは言えず,前述のとおり経済的支援の中心となる製薬企業と研究グループや医療機関の間には利益相反などの問題も残っている. これらを踏まえ,「臨床研究に関する提言(以下,提言)」には,人材・組織の育成,プロセスの改善,研究契約書の締結などを含めており,また行政,学会,業界および大学に対する要望もまとめた.詳しい背景の解析や考察については日本製薬医学会のホームページに掲載中の提言(図1)を参照されたい3).
今後の展望:質の高い臨床研究によるエビデンス構築の実現を新医薬品は効果・安全性に関するデータをもとに規制当局の承認を受けるが,承認前には十分に解明されていない事象もあり,承認後も継続して臨床研究により解明していくことが必要不可欠である.しかし,わが国では臨床研究のためのインフラが十分に発達しておらず,医師がボランティアで承認後の臨床研究を実施するという現状にある. このため,日本製薬医学会は既承認薬を用いた臨床研究・試験が国際的なレベルに到達し,そのエビデンスに基づいた成果が医療の改善に寄与して国民の健康の増進につながるように,関係各位に以下の要望を提言する. 行政への要望: 臨床研究にも治験のような国家的支援を 具体的には,それを実施しやすくする法的枠組みの普及推進(認定NPO法人化への支援),財政的支援(既存の科学研究費の増額および臨床研究中核病院構想の質的充実),研究・試験の成果が保険償還の対象となるよう添付文書に反映される等の法規上の手立ての設定を要望する. 新薬の承認申請のために行われる治験には法律に基づいたGCPが適用され,公的機関による詳細な規制が行われているが,承認薬を用いた臨床研究であれば,代わりにヘルシンキ宣言および臨床研究に関する倫理指針を遵守する旨の方針適用を要望する. 学会への要望: ネットワーキングでリーダーシップの発揮を 臨床研究のうち,特に臨床試験については,わが国では医師の個人的努力によるところが多いのが現状であるが,その多くは中小規模医療機関での実施であり,多施設をネットワークした組織的な支援が必要とされているため,こうした取り組みに学会が積極的に取り組んでいくことを期待する. 製薬業界への要望: 寄付金ではなく研究助成契約に基づいた財政支援を 今後,企業と医師・医療機関との関係を透明なものにするには,覚書または契約書(表1)の締結を通して臨床研究の経済的支援を行うことを提案する.これにより,科学的プロトコールに基づいた国際的なレベルのエビデンスが医療現場に提供されることが期待される.また,契約をすることで複数年度の財務見通しの構築が可能となり,医療機関,臨床研究施行団体の安定運営が可能になることが期待される.
契約の金額面については,治験で行われているポイント制に類似の経済合理的な枠組みの設定を業界が主導することを提案する.これにより,合理的で透明な契約関係が形成され,かつ医療機関等の事務量の軽減につながることが期待される. 大学への要望: 臨床研究教育で医師のマインドの転換を ■製薬医学会からの呼びかけ臨床研究のあり方については各々の製薬企業,研究グループ,医療機関などで必ずしも足並みが揃っておらず,この提言に関係者すべての同意が得られているわけではない.しかし,医療の発展に欠くことのできない,質の高い臨床研究の推進には早急な手立てが必要と考え,この提言を発表した. 日本製薬医学会は過去にも「薬害再発防止のための提言」「新たな安全対策の実現に向けての提言」を発表してきた(http://japhmed.jp/参照).今後とも製薬医学上のさまざまな課題について建設的な意見をタイムリーに提供し,日本の医学界の一員として,医学的にみて必要(いわゆるunmet medical needs)とされる新薬開発の推進や医薬品の適正使用の促進により,医学・医療の進歩に貢献していきたい. この機会に,より多くの関係者の皆様に日本製薬医学会活動へのご参加を賜り,さらなる発展を祈願するところである. 文献 今村恭子 |