新型コロナウイルスワクチンの米国における現状と今後
寄稿 紙谷 聡
2020.10.19
【寄稿】
新型コロナウイルスワクチンの米国における現状と今後
紙谷 聡(エモリー大学小児感染症科)新型コロナウイルスによるパンデミックは,世界中の人々の健康や経済への深刻な被害をもたらしています。この勢いを弱めるためには,手洗い,マスクの着用,社会的距離の確保など感染拡大防止のさまざまな対策が最も重要ですが,ワクチンによる集団免疫の獲得も期待されています。
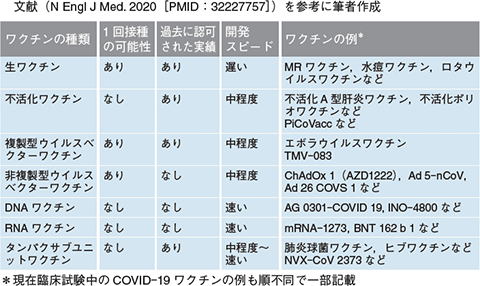
2020年9月30日現在,世界保健機関(WHO)によると世界で192種類の新型コロナウイルスワクチン(以下,COVID-19ワクチン)が開発中であり,そのうち41種類のワクチンが人体での臨床試験を行っています。COVID-19ワクチンは,さまざまなワクチンのプラットフォームをもとに開発されています(表)。このうち,DNA/RNAワクチンなどは新しいプラットフォームですが,SARSやMERSの流行時に行われた基礎研究の成果や,培養などを要さず遺伝子情報をもとに製造される新しい手法などによって今回の迅速な開発が可能になっています。
| 表 ワクチンプラットフォームの種類と特徴(クリックで拡大) |
 |
パンデミック下のCOVID-19ワクチンの臨床試験
従来の方法では臨床試験は段階(第I相~III相)ごとに順番に行われていましたが,パンデミック下という特殊な状況においては,それぞれの段階の試験が一部オーバーラップした形で米国では進行しています(図)。しかしながら,各試験については従来通り厳格な基準の下に進行しており,安全性や効果に問題が生じた場合はすぐに試験を中止してその後のワクチン接種は取りやめるというプロトコールに従って行っています。
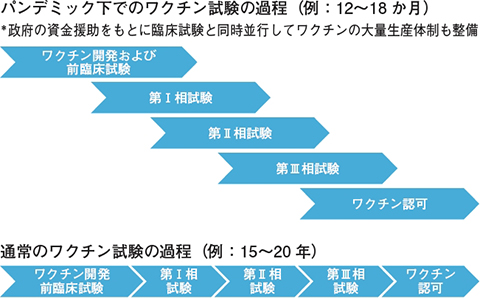 |
| 図 パンデミック下でのワクチン試験の過程(クリックで拡大) |
よって急ピッチでワクチンの開発や治験が進行しているとしても安全性の評価が最優先項目であることに変わりはなく,各段階でチェック項目があり,それらの基準を満たさなければ次の段階へは進めない形で治験が行われています。結果を急ぐあまりに安全性評価をおろそかにして予防接種への信頼を失ってしまっては本末転倒であり,接種後に比較的時間が経過してから起きる稀な副反応の検出も含め,各段階の被検者を観察することが極めて重要です。
懸念される副反応とは
現在COVID-19ワクチンで最も懸念される副反応は,ワクチンによって逆に感染が悪化してしまう病態であるVaccine-enhanced diseaseであり,抗体依存性感染増強現象(Antibody-dependent enhancement:ADE)およびワクチン関連増強呼吸器疾患(Vaccine-associated enhanced respiratory disease:VAERD)の2つに分けられます。
ADEは,ワクチンによって産生された抗体がウイルスの感染を防ぐのではなく,逆にFc受容体を介してウイルスが人間の細胞に侵入するのを助長し,ウイルス感染を悪化させてしまう現象です。これは,ウイルスに対する中和作用の低い抗体が多く産生される場合に生じる現象で,デング熱に対するワクチンなどで報告されています。一方,VAERDは1960年代にRSウイルスや麻疹に対する不活化ワクチンで認めた現象ですが,やはりワクチンによって中和作用の低い抗体が産生され,その抗体がウイルスとの免疫複合体を形成し,補体活性化を惹起して気道の炎症を引き起こすものです。さらに,この不完全な抗体はTh 2細胞優位の免疫反応も惹起して気道内にアレルギー性の炎症を引き起こします。これらの病態によって,より重症なRSウイルス感染をワクチン接種者に認めたのです。
ADEやVAERDを防ぐには,高い中和作用を有する抗体を産生させ,かつTh 1細胞優位の免疫反応を惹起するワクチンの開発が必要だと考えられています。そのためには立体構造的に正しくかつ安定した,質の高いスパイク糖たんぱく質(抗原)をワクチンによって作りあげることが重要です。現時点で学術誌に報告されているワクチン(mRNA-1273, ChAdOx 1, Ad 5 vectored vaccine, BNT 162 b 1など)は,いずれも高い中和抗体反応を認め,一部はT細胞性免疫反応も確認できており(mRNA-1273はTh 1細胞優位の反応も確認),この基準を満たしている可能性があります。また,9月上旬までに医学誌に発表された報告では,接種部位の痛みや倦怠感,発熱などの反応はあるものの,深刻な有害事象は認めておらず,安全性に一定の期待が持てる結果となっています。しかし,ADEやVAERDの可能性を正しく評価するためには,ワクチン接種者が実際に新型コロナウイルスに感染したときにどのような反応が起きるかを対照群と比較する必要があり,今後の第III相試験を含めた安全性評価および後述するワクチン認可後の安全性モニタリングが鍵となります。
CDCおよびACIPのワクチン認可後への対応
米国疾病予防管理センター(CDC)は,インフルエンザ用の従来の全国サーベイランスなどを土台にCOVID-19のサーベイランスシステム(COVID-NET)を構築しています。これらの疫学データの分析やモデリングなどの結果をもとに,どのようにワクチンを国民に分配すべきか,予防接種の実施に関する諮問委員会であるACIP(Advisory Committee on Immunization Practices)会議を通じて専門家が議論しています。本稿の執筆時点では,医療関係者,エッセンシャルワーカー,高リスクの人々などへの優先接種が検討されていますが,今後の疫学データや供給状況に応じて最終的な決定が行われる予定です。また,多くの人口をカバーする予防接種の実施のために,CDCのみならずワープ・スピード作戦チームや各州の保健局が連携してその体制構築に尽力しています。
ワクチンの供給体制を早急に整えると同時に,ワクチン認可後の予防接種有害事象の安全性モニタリング体制を整備することも極めて重要になります。国際的には,WHOなどが主導するCOVAXプログラムなどの枠組みによってグローバルなワクチン供給への協力体制の構築を進める一方,ワクチンの安全性モニタリングも重要な事項として対策が進行しています。米国では,受動的安全性モニタリングシステムと呼ばれるVAERS(Vaccine Adverse Event Reporting System)に加えて,能動的安全性モニタリングシステムであるVSD(Vaccine Safety Datalink)や,予防接種の副反応に関するコンサルテーションを行うCISA(Clinical Immunization Safety Assessment)などの既存の体制強化を進めています。安全性モニタリングの過程として,まず第一にVAERSで受動的に医療者,製薬会社や患者さんなどから報告される有害事象(因果関係の有無を問わず)を集計・解析します。その際,真の副反応である(因果関係のある)可能性が否定できない場合,次の段階として要となるVSDによってさらなる検証を行います。VSDは1990年よりワクチンの安全性の検証を行い国内外に研究結果を発表してきた実績を持つ極めて優れたシステムで,米国の人口の1200万人以上をカバーする予防接種データのコホートを有しています。この予防接種データと参加病院群の電子カルテからの臨床データを結び付けて,VAERSに報告された有害事象が真の副反応であるか否かをさまざまな研究デザインをもって検証します。
*
以上,ワクチンの開発から臨床試験,そして認可後の分配や安全性モニタリングについての概要を述べました。未曽有の感染症へのワクチンの普及に対応するためには,関連する行政機関や医療機関の連携だけではなく,一般の方々への予防接種の啓発が不可欠です。そのため,第一線で患者さんを診る医療従事者,そして地域に深くかかわる保健師などからの予防接種の啓発こそが要であると考えています。ポリオ根絶計画などで多大なる貢献を果たしたDr. Walter Orensteinの言葉と共に,一般の方々への予防接種の啓発の重要性を強調して本稿の結びとさせていただきます。
 かみだに・さとし氏
かみだに・さとし氏
日本・米国小児科専門医。2008年富山大医学部卒。Emory大小児感染症科に所属し小児感染症診療に携わる傍ら,NIH ワクチン治療評価部門の共同研究者としてCOVID-19ワクチンなど新規ワクチンの臨床試験や安全性評価に従事。また,CDC Vaccine Safety Research FellowとしてVaccine Safety Datalinkチームに所属し,認可後のワクチンの安全性評価にも関与している。本稿は個人の見解です。
いま話題の記事
-
人工呼吸器の使いかた(2) 初期設定と人工呼吸器モード(大野博司)
連載 2010.11.08
-
忙しい研修医のためのAIツールを活用したタイパ・コスパ重視の文献検索・管理法
寄稿 2023.09.11
-
連載 2010.09.06
-
事例で学ぶくすりの落とし穴
[第7回] 薬物血中濃度モニタリングのタイミング連載 2021.01.25
-
寄稿 2016.03.07
最新の記事
-
医学界新聞プラス
[第3回]人工骨頭術後ステム周囲骨折
『クリニカル・クエスチョンで考える外傷整形外科ケーススタディ』より連載 2024.04.19
-
医学界新聞プラス
[第2回]心理社会的プログラムを分類してみましょう
『心理社会的プログラムガイドブック』より連載 2024.04.19
-
医学界新聞プラス
[第5回]事例とエコー画像から病態を考えてみよう「腹部」
『フィジカルアセスメントに活かす 看護のためのはじめてのエコー』より連載 2024.04.12
-
医学界新聞プラス
[第3回]学会でのコミュニケーションを通して自分を売り込む!
『レジデントのためのビジネススキル・マナー――医師として成功の一歩を踏み出す仕事術55』より連載 2024.04.12
-
医学界新聞プラス
[第1回]心理社会的プログラムと精神障害リハビリテーションはどこが違うのでしょうか
『心理社会的プログラムガイドブック』より連載 2024.04.12
開く
医学書院IDの登録設定により、
更新通知をメールで受け取れます。
