座談会
ヒト22番染色体のDNAシーケンシング完了
 清水信義氏(司会,翻訳) 慶應義塾大学医学部教授 |
 蓑島伸生氏 慶應義塾大学医学部助教授 |
 イアン・ダンハム氏 英国サンガーセンター主任研究員 |
 エイドリアン・ハント氏 英国サンガーセンター研究員 |
ヒト22番染色体解読終了
清水 本日はお集まりいただき,ありがとうございます。 1999年12月2日はヒトゲノム計画の最初の成果として22番染色体のDNAシーケンシングが完了し,生物学史上記念すべき日となりました。ヒト生物学の新たな革命の第一歩とも評され,ヒトの遺伝学や生命の尊厳に関する考え方まで変えると言われました。ヒトゲノム計画が開始されてちょうど10年目,まさに国際協力が生んだ理想的な研究成果とも讃えられました。
1999年12月2日はヒトゲノム計画の最初の成果として22番染色体のDNAシーケンシングが完了し,生物学史上記念すべき日となりました。ヒト生物学の新たな革命の第一歩とも評され,ヒトの遺伝学や生命の尊厳に関する考え方まで変えると言われました。ヒトゲノム計画が開始されてちょうど10年目,まさに国際協力が生んだ理想的な研究成果とも讃えられました。
今日は今回の協同研究の主役を演じた英国サンガーセンターのイアン・ダンハム氏とエイドリアン・ハント氏の両博士が,第22回日本分子生物学会のワークショップに参加されたのを機に,私が聞き手の役割を果たし,慶應義塾大学のチームリーダーである蓑島伸生氏を交えて共同研究を振り返ってみたいと思います。
ヒト22番染色体
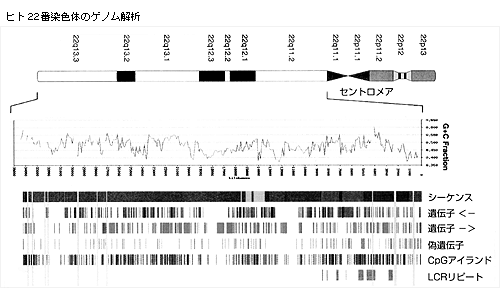
清水 最初にダンハム氏から,今回の成果を簡単にまとめていただけますか。ダンハム 一言で言えば,ヒト22番染色体のDNAシーケンスを決定したということです。このシーケンスは11か所の小さいギャップがありますが,全長3346万塩基対です。すべてのギャップはそのサイズが測定されていますので,22番染色体の97%を決定したことになります。シーケンス情報から545個の遺伝子と134個の偽遺伝子を発見しました。偽遺伝子というのは,かつては遺伝子でしたが,今は蛋白質を産生することができない形になっているシーケンスのことです。
他にもたくさんの興味深い特徴があります。例えば,新規の低頻度反復配列がセントロメア近傍に見つかりました。これは欠損や重複によって起こる症候群に関与していることがわかっていましたが,そのシーケンスと分布が確実になったわけです。
清水 22番染色体の全容に関してもう少し詳しく解説していただけますか。
ダンハム 545個の遺伝子は実際には染色体DNAシーケンスの約40%を占めていますが,蛋白質をコーディングしているシーケンスはわずか3%にすぎません。偽遺伝子は134個だったのですが,2種類に分類できます。偽遺伝子の8割はいわゆるレトロトランスポジションによる産物と考えられます。残りの偽遺伝子は遺伝子が複製によってコピーを増やした後,一部が突然変異を起こしてその機能を失ったものです。一方,染色体の40%以上はいくつかの高頻度反復配列でできていますが,なぜそのような配列がそこに存在するのかは興味深いことです。
さらに,遺伝子はそのサイズや構造に関してきわめて変化に富んでいます。わずか1個のエキソンからできている遺伝子や,多数のエキソンからなっている遺伝子が見つかっています。遺伝子のサイズも1000塩基対から50万塩基対までさまざまで,小さな遺伝子が大きな遺伝子の隣にあることもふつうでした。
清水 特にめずらしい遺伝子構造はありましたか。
ダンハム はい。2例だけ,ある遺伝子のイントロンの中に別の遺伝子が隠れている例がありました。このような発見は初めてではありませんが,きわめて稀で,1例ではすでにいずれも機能していることがわかっています。大きいほうの遺伝子はシナプシンでシナプス形成に関与しており,小さいほうの遺伝子は目の黄斑部変性を起こすソルスビー偽炎症黄斑ジストロフィーの原因遺伝子です。これらの遺伝子は互いに逆向きに位置していて異なるDNA鎖から転写されます。同じ鎖から転写される2個の遺伝子というのはまだ知られていません。
偽遺伝子とは何か
清水 偽遺伝子についてその定義と意義についてよく聞かれるのですが。ダンハム 偽遺伝子の定義は,ある機能をもった遺伝子にきわめてよく似たシーケンスをもっているものの,蛋白質を作れないものという意味です。時には,欠損蛋白を作っているかもしれませんが。ホモロジーの高い配列部分がオープンリーディングフレームの外側まで続いていることが多いのです。こういった偽遺伝子の8割はイントロンを欠損しています。ホモロジーの高い部分は一続きのシーケンスであり,おそらくmRNAが逆転写されてDNAとなり,進化の過程のある時期になんらかの理由で染色体に挿入されたと考えられます。偽遺伝子の2割は祖先遺伝子の複製によって重複が起こったものであり,互いに隣接していることが多いのです。これらの複製された遺伝子も進化の過程で突然変異が起こり機能を失ったものと考えられます。この過程に進化の選択圧はかかっていなかったと思われます。
清水 蓑島先生,重複によってできた遺伝子や偽遺伝子の具体例をあげてください。
蓑島 はい,最もよい例はいわゆる「LCR22」(22番特異的低頻度リピート)だと思います。この中にGGT(ガンマグルタミルトランスフェラーゼ)やBCR(ブレークポイントクラスター領域)遺伝子がたくさん存在しています。これらの1割弱が機能遺伝子ですが,9割以上は機能を失っています。これらの他にまさにリピートが存在していますが,本当は未知の遺伝子から由来したのかも知れません。セントロメアから1Mbの領域には本当にたくさんの偽遺伝子が存在しますが,他の染色体にある遺伝子,例えばF8VWF(血液凝固第 VIII 因子フォンウィレブランドファクター)やNF1(ヒト神経線維腫症1型)などが乗り移ってきたもので,22番染色体上では構造は完璧ではありません。
清水 疾患の遺伝子としてはどのような発見があったのでしょうか。
ダンハム そうですね,35個の疾患や症候群が22番染色体にリンクしています。それらの原因遺伝子がほとんど同定されました。
清水 ところで,染色体全体で他の哺乳動物とどのような進化的な関係がわかったのでしょうか。
ダンハム 古くから知られているように,ヒトとマウスでは遺伝子の種類とか配列の順序などはきわめてよく保存されています。今回の解析によって,ヒト22番染色体はマウスでは8個の異なる染色体に分散していることがわかりました。その切断点をヒトDNAの側ではっきりと示すことができました。したがって,染色体が進化してきた様子が手に取るようにわかります。もちろんマウスのシーケンスがわかった時に初めて,進化の過程で何が起こったかを完璧に理解できるのですが。切断点の実際のシーケンスを知ることは進化的にきわめて重要ですし,また欠損による症候群の理解にも大切です。
サンガーセンターの研究体制
清水 さて,今回のようなゲノムDNA解析には多大な労力と熱意が必要なのは言うまでもありませんが,ハント先生,あなたはサンガーセンターで現場の指揮をとるという最も重要な役割を果したと聞いていますが,ひと仕事終えた今,どのようなお気持ちですか。ハント 研究チームの皆が長い年月めざしてきたゴールに到達できて,本当に満足感に浸っています。
清水 実際には何年かかったのですか。
ハント 個人的には5年半です。ちょうど5年前にシーケンシングが開始されました。ゲノムプロジェクトとしては10年です。
清水 何台のDNAシーケンサーを使い,何人の研究者が働いたのですか。
ハント サンガーセンターには新型のシーケンサー「3700」が30数台と旧式の「377」および「373」が150台以上あります。それらを1日2サイクル昼夜交代制で動かしてDNAシーケンシング全般に用いていますが,22番染色体の完成のために,ラストスパートの数か月間は全キャパシティの半分以上を利用しました。また,ショットガン法で得られた短いシーケンスを継ぎ合わせる編集の段階が終わっても残っているギャップを埋める最終段階では,それ専門のチームが5台の「373」をフルに使いました。研究者だけでも100名以上,技術者を含めると延べ200人以上が働きました。
清水 要するにサンガーセンターが70%,日米が15%ずつあわせて30%をシーケンシングしたのですが,よくコストのことを聞かれます。いくらかかったのでしょうか。
ダンハム サンガーセンターも他のセンターも同じだと思いますが,1塩基あたり20ペンス(40円)くらいでしょう。したがって,サンガーセンターでは完成までに700万ポンド(14億円)を費やしたと思います。これから続くゲノム解析に比べれば高くついているように思われますが,とにかく最初のことなので,諸々の初期投資と技術開発にかけた費用が大きいと思います。これからはうんと安くできるでしょう。
清水 開発研究のコストの算出はいつも難しいのですが,この5年間に注ぎ込まれた人件費や機器購入費,消耗品をすべて積算しておおむねこんな数字になったということでしょう。日本では機材の輸入などを勘案して2-3倍になっていると思います。
ダンハム そうです。
解読作業を支えた技術開発
清水 このプロジェクトにはDNAライブラリーを作製したり整列クローンを用意したり,本当にたくさんの研究者が参加したと思います。その意味で真の国際協力だったと思います。ダンハム まったくその通りです。この研究は国際協力の最もよいお手本になったと思います。シーケンシングの実行部隊以外にも,22番染色体研究における長年の歴史の中で,スウェーデンやカナダのグループも活躍しました。論文の著者は200人を超える異例な数になりましたし,謝辞で評された人々もたくさんいます。まさに巨大プロジェクトだったのです。
清水 技術的に何か大変困難だったポイントをあげてください。
ハント 最も難しかったのは,DNAクローンによっては強固な2次構造をとるためシーケンシング反応がまったく進まない時でした。もちろん,そのつど,実験条件を改変・改良して問題を解決しました。その間,本当にたくさんの細かい技術が考案・開発されました。もちろん,今後のゲノムシーケンシングに役立つものばかりです。
清水 分子生物学的な問題ばかりでなく,コンピュータ関連の難題もあったと思いますが。
ハント そうです,これまでにないさまざまなコンピュータプログラムが考案・開発されました。コンピュータ自身の性能アップやネットワークの充実にも目を見張る進歩があり,データ処理が画期的に向上しました。
清水 その通りだと思います。しかし,人によっては多数のDNAシーケンサと多額の研究資金があれば誰でもできると思っています。このあたりはいかがでしょうか。
ダンハム その答えは「ノー」です。実際,クローンごとのシーケンシングを完成するにあたって,さまざまな技術的な障害がありました。CpGアイランドやタンデムリピートのようなところのシーケンシングは,逐一個別に解決しなければなりませんでした。新しい手法の開発はいたるところで必要だったのです。さらに,染色体のマップやシーケンシングするためのDNAクローンを揃えることも大変な英知を要するものでした。事実,今回のシーケンスにもギャップが残っており,それはその場所のクローンが10種類以上のライブラリーの中にも存在しなかったからです。ある種のヒトのDNAシーケンスは大腸菌の中では複製されないことの表れかも知れません。このようなシーケンスをもつクローンを分離する技術の開発がまだ残されています。
コンピュータソフトウェアに関しては,遺伝子探しの新たなアルゴリズムの開発が必須です。現状のプログラムではほんの一部の遺伝子しか予測できていないので,生物学的実験を併用して遺伝子であることを確証する手続きをとっているのです。例えば,今回,817個の遺伝子を予測しましたが,325個は発現データとマッチしない。100個は機能遺伝子と思っていますが,もっと精度の高いアルゴリズムの開発が絶対に必要です。
蓑島 私も同感です。われわれの担当した領域はセントロメアに近いリピートだらけの領域で,大変てこずったわけです。大きなDNAクローンを使わず,小さなDNAクローンをこまめにつないでいってはじめて,正確な長いシーケンスにすることができました。このような細かいノウハウは今後のDNAシーケンシングに活用されてスピードアップできると思います。
22番染色体解読がもたらすメリット
清水 22番染色体がまさに他の染色体のモデルになったということだと思います。3346万塩基対の情報がもたらす利益には,他にどんなことがあるでしょうか。ダンハム 最大の利益はシーケンスそのものに秘められた遺伝子であり,それらを個別に研究する術が与えられたことです。特に,個々の遺伝子における発現調節エレメントの研究や,複数が調和をとって働く分子機構などの研究が飛躍的に進むと思います。22番染色体にリンクした疾患であれば,今回のシーケンスの中に必ずその原因遺伝子が潜んでいることになります。候補遺伝子に当たりをつけることも容易です。シーケンスを参照するだけで,これまでの研究では考えられないほどのスピードで機能解析や疾患遺伝子探索が進むと思います。
清水 ところで,われわれが今日手にしている技術で推定10万種類の遺伝子すべてがそのうち発見されると思いますか。
ダンハム 必ずその時は来ると思います。しかし現状では,シーケンス情報だけから遺伝子をすべて発見することは無理だと思います。これまでにわかっている遺伝子ですら,そのゲノム構造が完全にわかっているものは少ないのです。おそらく22番染色体には今回予測した以上の遺伝子が存在すると思います。コンピュータで予測したCpGアイランドは遺伝子のプロモータ領域に相当するのでその数から推定すれば100から300個の遺伝子が発見される可能性があります。これらの遺伝子はシーケンスのさらに詳しい解読と分子生物学的解析によって確証されると思いますが,時間はかかるでしょう。DNAチップなどの最新技術を22番染色体に応用することで発現プロファイルの解析も容易になるでしょう。しかし,なんといっても該当するシーケンスを標的できることが最大のメリットです。
清水 おそらく遺伝子によってはその発現の様子がまったくわからないものも多いと思いますが,そのような場合その発見は困難をきわめるでしょう。
ダンハム その通りです。遺伝子によっては非常に限られた組織で特別の時期に微量しか発現されないものも多く,既存の技術では発見は不可能なのです。マウスのシーケンスを参照することで両者にホモロジーがあれば,それが進化の過程で保存された遺伝子であると言い切れるかも知れません。それでも最終的には発現を証明しなければならず困難は予想されます。
清水 蓑島先生,いかがですか。
蓑島 まさに,分子生物学的な技術と方法論のブレークスルーが必要ですし,シーケンスをより迅速・より正確に解読するコンピュータソフトウェアの開発が必至です。さらに,未知遺伝子を強制発現させる新たな実験系を開発することも必要です。
清水 ところで,先生はこれから新たに,どのような研究から取りかかりたいとお考えですか。
ダンハム たくさんあります。第一に,今議論したばかりのことです。コンピュータ予測した遺伝子が本物かどうか,それらを適当な組織で発現させて実証することです。そして,部分的にしか構造が決められてない遺伝子の全ゲノム構造を決めることです。これらも当然,発現制御を含めて解明する必要があります。新規遺伝子やそこから作られる蛋白質の機能は,多くの場合簡単には推定できないので,それを徹底究明することも急務です。これらは大変な労力のいる仕事ですが,すべて明日からでもやるべきことです。
清水 他にはいかがですか。
ダンハム ギャップを埋める問題がありますね。技術開発です。
SNPの意義
清水 さて,シーケンシングの過程でたくさんのSNP(1塩基置換多型)を見つけたと思いますが,その結果と意義についてコメントください。ダンハム シーケンシングに用いたDNAは同じ1人の人間からではなく,人種も個人も違う複数の人からのものでした。また,同じ個人でも2本の染色体でハプロタイプが異なります。つまり異なる染色体から由来するシーケンスは時に差が認められます。整列クローンの重複部位のシーケンスを比較することによって,1万1118個のSNP(gSNP)を発見しました。すでにSNPは1000塩基に1個の頻度で見つかると言われており,その試算と一致していました。塩基が変化するに当たってtransitionに対するtransversionの割合も,これまでの報告とほぼ一致していました。コーディング領域のSNP(cSNP)もいくつかの遺伝子で観察しています。
清水 疾患遺伝子の追究に多くの研究者がSNPに期待をかけていますが,cSNPとgSNPのどちらがより有効かとお考えでしょうか。
ダンハム gSNPの大きな利点は,容易にしかも大量に得られることです。今回得たSNPのわずか1%がcSNPすなわちコーディング領域から由来したものでした。すでに指摘されているように,cSNPにはかなりの抑制がかかっていると言えます。gSNPは染色体全体に広く分布しており,場所によってはきわめて頻度が高いのです。22番染色体には数十万塩基の領域に1000塩基に1個のSNPが何か所も見いだされています。疾患とのリンケージデータがあれば直ちにその領域を絞り込むことができ,原因遺伝子を捕まえることが容易にできます。これらの高密度のSNPを使えば,複数の遺伝子と環境因子が関与する生活習慣病の原因遺伝子追究が系統的に行なえると思います。当面は22番染色体関連に限定されるでしょう。例えば分裂症は22番染色体にマップされているので,その遺伝子は遠からず捕まるでしょう。
清水 cSNPでは膨大な数の候補遺伝子があらかじめわかっていることが必要で,現状ではその数は限られています。
ダンハム cSNPは理想的には良いアプローチだと思います。すべての候補遺伝子のcSNPを手に入れればよいのですから。ところがそのために,たくさんのDNAサンプルを繰り返しシーケンスしなければ有用なSNPは探せないので,最終的には随分のシーケンス量になります。すでに述べたように,SNPはコーディング領域には比較的少ないので,効率は悪いと思います。22番染色体にもどって言えば,その全シーケンスの中に遺伝子を同定しているので,プロモーター領域を含めてそのバリエーションを系統的に検索できるメリットがあります。きわめて強力なアプローチになると思います。どちらも有効と思いますが,gSNPアプローチのほうが少なくとも当面は有効と思います。
清水 日本ではcSNPしか認めないという方針で研究が計画されており,きわめて遺憾に思っていたところです。貴重なコメントだと思います。
蓑島 22番染色体には,猫目症候群やディジョージ症候群というような,染色体の特定領域の欠損や重複が関与している疾患があります。今回,それらの領域からたくさんの遺伝子を同定しましたので,いずれも候補遺伝子としてこれから精力的に研究を進めていきたいと思っています。
ダンハム このような症候群では同様の欠損や重複が必ずしも同じ臨床症状を呈するとは限らないので,その他の遺伝的背景の影響が推定されています。一方,この領域のSNPが関与しているとも言われていますので,まさに分子機構の解明は興味津々といったところです。
清水 遺伝子のコピー数の変化がどのようにして病気を起こすかという問題はまったく手つかずで,その分子機構の解明は大きなチャレンジですね。ヒトの分子生物学のフロンティアとも言えると思います。
ダンハム その通りです。

22番染色体シーケンス完了が与えるインパクト
清水 それでは,22番染色体シーケンスの完了は21世紀のサイエンスにどのようなインパクトを与えると思いますか。ダンハム 21世紀はすぐそこまで来ているわけですが,最大のインパクトは22番染色体に関して2度とシーケンシングをやらなくてもよいことです。研究者は遺伝子の機能や発現調節,シーケンスのバリエーションによる発現への影響,正常と病気の状態での遺伝子の働きなどの研究に没頭できるようになります。これらは誰でもが研究対象にしたいと思っていることでしょう。
もう1つのインパクトは,22番染色体完了に刺激されて今から3年以内に全染色体のシーケンスが決定されることです。DNAシーケンスを基盤にして,すべての染色体を研究できることは素晴らしいと思います。
蓑島 企業へのインパクトも無視できません。DNA診断やゲノム創薬などの分野が遺伝子産業として活気づいてきています。22番染色体だけでもたくさんの遺伝子があり,それらは遺伝子産業のネタになりつつあります。遺伝子情報の利用と開発は計り知れないと思います。
ダンハム 同感です。22番染色体のすべての遺伝子はそれぞれ生物学的に重要な働きをしていると思います。そして,いずれも治療薬開発に役立つために特定の病気に関与していることは必ずしも必要ない。1つの代謝系に関与している遺伝子であれば,そのどれかを標的にすればよいことになります。遺伝子が他の遺伝子とどのように相互作用しているかがわかってくれば,そのプロセス全体を標的にした薬のデザインも行なわれるようになると思います。
ゲノム解析はチャンレジ
清水 DNAシーケンシングはわが国では知的活動であるとは認めない向きもあります。人類にとってかつてないチャレンジだと思うのですが,あなたの国ではどのように受け止められていますか。ダンハム ゲノム解析はまさにチャレンジです。基本技術はあったとしても,それを正しく使いこなして未知の問題を解決することとは別の話です。作業のスピードアップも大切な工夫で,そのために大量の精度の高いデータが素早く出せるようになりました。われわれはパイオニアの自負をもって,後に続く仕事がもっと効率的にできるようにという思いで,これまで努力してきました。ヒトゲノムのシーケンシングはいずれ完了するでしょうが,DNAシーケンシングは,その他の生物のゲノム解析へと進むことは間違いないと思います。
ゲノムプロジェクトの姿勢
清水 今回大量の遺伝子情報が創出され,それはすべて公共データベースに制約なく登録されました。このことはまさにヒトゲノムプロジェクトの精神だったと思います。しかし,一方では企業の動きが急に激しくなっていますが,どのようにお考えでしょうか。ダンハム ヒトゲノムシーケンスがすべての人に提供されることは最も重要なことです。それは企業にも当てはまります。シーケンス情報へのアクセスを制約すれば,新薬や新治療法の開発を遅らせることになるし,遺伝子技術を人類が利用することも障害すると思います。だからこそDNAシーケンスは直ちに公共データベースに登録するという姿勢を強くとってきたわけです。
清水 今回の大量シーケンス情報を特許申請しなかったことはもったいないという意見も多いのですが。
ダンハム シーケンス自身は発明ではありません。発見なのです。すでに身体の中にあることはずっと知っていたからです。シーケンスの決定は大変でしたが,特許はシーケンス情報や遺伝子の生物学的知識を使って行なう発明や創薬にこそ与えられるべきです。
清水 おっしゃる通り,将来の研究基盤なのですからね。ところで,遺伝子ビジネスのことをなじって「遺伝子は金(きん)なり」というか「遺伝子は金(かね)なり」と言われています。
ダンハム 微妙な東洋的表現ですね。
今後の展開
清水 さてヒトゲノムプロジェクトをひとまず置いて,先生がたは次にはどんな夢をお持ちですか。ダンハム 私の夢は,さきほど述べたことをすぐに実行することです。遺伝子の相互作用という問題です。ですからサイエンスフィクションはありません。本当に重要なことの1つは,シーケンシングを今よりも飛躍的に早く行なえるようにすることです。なぜなら,個人のゲノムを素早くシーケンスして,病気の診断をすることが現実に求められているからです。
清水 それは現行の技術でないものを開発しようということですね。
ダンハム そうです。DNAシーケンスから情報を読みとることが進めば進むほど,シーケンシングそのものがますます必要になってくるのです。
蓑島 今回の成果として,人によっては5万塩基対におよぶ大きなシーケンスを欠いているのに,日常生活に支障がないという例を経験しています。私は個人差の不思議を解いてみたいと思います。
清水 DNAシーケンスの情報は個人差の方向に傾いていくと思いますが,それとともに遺伝子情報の扱いに関心が寄せられています。このような傾向をどのように思いますか。
ダンハム 遺伝子情報の利用に関しての懸念は確かにあります。このような懸念を解消するためには,まず技術の最先端を人々に知らせること,そしてシーケンス情報を世界に知らしめることが肝要です。シーケンス情報は,疾患の発症機構や薬剤の作用機構を知るための重要な情報であり,その悪用を恐れることよりはるかに利益があることを訴えることだと思います。一般市民と広く議論することによって深い理解を得られるでしょうし,無意味な批判も避けられると思います。
清水 ゲノムシーケンスは特別な人のDNAを解析したのかとよく質問されますが,いつも「ヒト」という生物の標準シーケンスを決めたのだと答えています。
ダンハム そうです,われわれが手にしたシーケンスは特定の人物のものではなく,誰にも当てはまる標準なのです。ヒトのDNAシーケンスはその99.9%が同じなのですから。
清水 ところで,ヒトとチンパンジーのシーケンスは99%同じと言われていますが。
ダンハム この1%の違いはまさに進化の過程で選択された結果であって,2つの種の分化を決めている遺伝子を突き止め,その正体を明らかにすることは大切だと思っています。
清水 さて,議論は尽きないのですが,エイドリアン,今回あなたにとって初めての日本だということですが,印象はいかがでしたか。
ハント 「エレガンス」の一言です。私の印象に残ったことすべてがそうです。すべてがエレガントで磨きあげられています。
清水 本日は大変実り多い討論をありがとうございました。ヒトゲノム計画が国際協力研究としてますます進展し,その壮大な目標――30億塩基対の解読――が1日も早く達成できるようお互いに頑張りたいと思います。国際社会の一員として人類の福祉と世界平和にも貢献できると信じております。
ダンハム そのように思います。
(了)
(1999年12月9日 福岡市にて収録)
(1999年12月9日 福岡市にて収録)


