連載
現代の感染症
7.院内感染
荒川宣親(国立感染症研究所/細菌・血液製剤部)人類が,1940年代半ばにペニシリンの工業的大量生産に成功して以来,半世紀が経過しようとしている。この間にβ-ラクタム薬をはじめ各種の抗生剤や抗菌剤の開発が意欲的に推し進められ,細菌感染症の治療は著しく進歩した。その結果,致死的疾患としての細菌感染症を軽視したり,「既に克服された問題」として捉える風潮が一部に見られた。しかし,メチシリン耐性黄色ブドウ球菌(MRSA)や多剤耐性グラム陰性桿菌による院内感染の広がりは,これが単なる錯覚に過ぎなかったことを示している。WHOや米国CDC(疾病対策センター)は,これら薬剤耐性菌による感染症をいわゆる「re‐emerging disease」と位置づけ,克服すべき最重要課題の1つに掲げ,対策に乗り出している。
カルバペネム耐性菌の出現の背景
細菌の外膜の主要な構成要素であるペプチドグリカンの生合成に関与するペニシリン結合蛋白(PBP)の機能を阻害するペニシリンやセフェムなどのβ-ラクタム薬は,入院患者に投与される抗菌薬の70%以上を占めている。中でも,広域抗菌スペクトルを有する第3世代セフェム,セファマイシン,カルバペネムなどの占める割合がわが国では多い傾向がある。しかも,これらの薬剤を化学療法の初期の段階で第1選択薬的に使う傾向が見られ,その効果として1980年代にはEscherichia coli,Klebsiella pneumoniae,Enterobacter cloacaeなどの腸内細菌による日和見感染症は漸減する傾向にあった。しかし,1990年代に入ると,これらの薬剤に耐性を獲得した株の分離が再び増加傾向に転じている。カルバペネム耐性菌
グラム陽性菌から陰性菌にまで幅広い抗菌力を発揮するカルバペネム薬は,β-ラクタム薬の中でも切り札的な存在である。1980年代の中ごろから,臨床でカルバペネム薬が使用されはじめ,現在,イミペネム+シラスタチン,パニペネム+ベタミプロン,メロペネムの3種類の製剤が臨床で利用されている。近い将来には,ビアペネムなども臨床への投入が予定されている。しかし,最近これらのカルバペネム薬に対し,耐性を獲得した,緑膿菌(Pseudomonas aeruginosa)やセラチア菌(Serratia marcescens)が全国各地の医療施設から分離されはじめている。これらの耐性菌のあるものは,メタロ-β-ラクタマーゼと呼ばれる特殊な酵素を産生することが,筆者らのこれまでの研究により明らかになった1)。メタロ-β-ラクタマーゼ
β-ラクタム薬を加水分解するβ-ラクタマーゼには,酵素の活性中心にセリン残基を持つセリン-β-ラクタマーゼと,亜鉛原子を活性発現に必要とするメタロ-β-ラクタマーゼの2種類が知られている1)。グラム陰性桿菌が通常産生するセリン-β-ラクタマーゼ(ペニシリナーゼまたはセファロスポリナーゼ)は,基質であるβ-ラクタム薬を加水分解する過程において基質と不安定なアシル中間体を形成する。しかし,メタロ-β-ラクタマーゼは活性中心に存在する亜鉛原子に結合した不安定なH2O分子がβ-ラクタム環を攻撃し加水分解する。その結果,この酵素は,通常の細菌が産生するセリン-β-ラクタマーゼにより分解されにくいカルバペネムやβ-ラクタマーゼ阻害剤をも容易に分解・不活化してしまうという憂慮すべき性質を示す(図1)。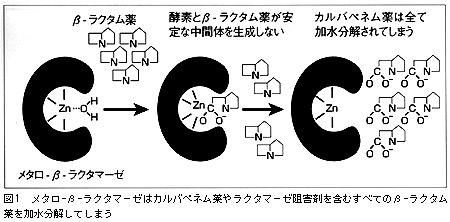
メタロ-β-ラクタマーゼ産生菌
メタロ-β-ラクタマーゼは,Stenotrophomonas maltophilia(当初はPeudomonas maltophiliaと呼ばれ,その後Xanthomonas maltophiliaと改名された)で最初に報告された。この菌種は,その染色体上に,メタロ-β-ラクタマーゼ遺伝子を持ちカルバペネムに生来耐性を示すが,病原性はそれほど強くなく,カルバペネム薬を投与されている患者において菌交代症の起因菌としてしばしば分離される。また,一部の株ではあるが,食中毒菌であるBacillus cereus,日和見病原菌であるAeromonas hydrophilaやBacteroides fragilis,Pseudomonas cepaciaなどでも同種の酵素を産生する株が報告されていたが,これらの菌種は,重大かつ広範な院内感染を引き起こすことは稀であったため,あまり問題視されてこなかった。しかし,最近,富山県内の病院から伝達性のカルバペネム耐性を示すPseudomonas aeruginosaが報告され2),問題視されていた。メタロ-β-ラクタマーゼ産生菌の特徴
メタロ-β-ラクタマーゼ産生菌は尿から分離されることが多い。それらのイミペネムなどのカルバペネム薬に対する耐性度は,低度から高度まで様々であるが,第3世代セフェム,セファマイシンには例外なく高度耐性を示し,しかも,β-ラクタマーゼ阻害剤とセフォペラゾンの合剤であるスルペラゾン(SBT+CPZ)に対しても高度耐性を示す特徴がある。筆者らは,セフタジジム(CAZ)とスルペラゾンの最小発育阻止濃度(MIC)がともに128mg/ml以上の臨床分離菌は,メタロ-β-ラクタマーゼ産生菌を疑い,PCR法によるスクリーニングを行ない,各地の多くの施設においてこの酵素を産生する菌が増加しつつあることを確認している3)。また,この酵素を産生する菌は,尿から多数分離される。これは,入院患者の尿中に数百mg/ml以上の高濃度で排出される各種のβ-ラクタム薬に対抗するうえでメタロ-β-ラクタマーゼの産生が好都合となることを意味している。したがって,この種の耐性菌の出現やそれによる院内感染を早期に発見するには,広域セフェム薬やカルバペネム薬の投与を受けている患者において,尿路感染症状の有無に関わらず,尿の定期的な培養検査と感受性検査(CAZとSBT+CPZ)を実施することが重要であると思われる。伝達性プラスミドにより媒介されているメタロ-β-ラクタマーゼ遺伝子
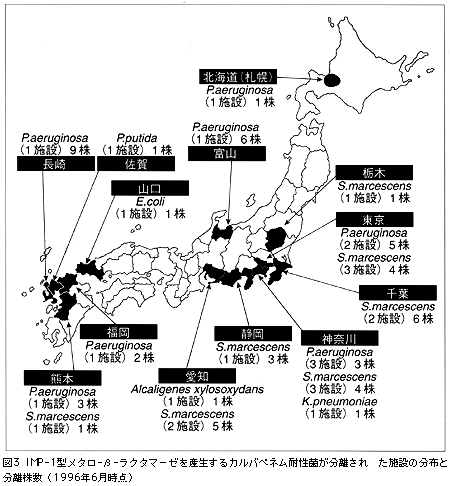
著者らの最近の研究により,日本においてプラスミド依存性に,新しいIMP-1型メタロ-β-ラクタマーゼを産生するP. aeruginosaやS. marcescensなどが全国的に分布しはじめ,一部の医療施設では既に院内感染の様相を呈していることが明らかとなってきた。筆者らが最初にS. marcescens TN9106株から発見しIMP-1と命名したメタロ-β-ラクタマーゼは,これまでに報告されている他のメタロ-β-ラクタマーゼのどれとも似ておらず,近いものとしてはB. fragilisのメタロ-β-ラクタマーゼがあるが,アミノ酸の一致率が35%程度であった3)。筆者らがS. marcescens AK9373株から分離したIMP-1型メタロ-β-ラクタマーゼ遺伝子は自己伝達能のある巨大プラスミド上のインテグロン構造の中に存在していた(図2)。そのため,この遺伝子は,耐性菌から106~107の頻度で比較的容易にE. coliなどの感受性受容菌に接合伝達されることが観察された。P. aeruginosaにおいても同様な伝達現象が確認されている。その結果,急速にこの耐性遺伝子が,多種類のグラム陰性菌の間に拡散する危険性が危惧された。事実,その後の筆者らの研究により,関東・中部を中心に北は北海道(札幌)から南は九州(熊本)まで20以上の医療施設からIMP-1型メタロ-β-ラクタマーゼを産生する多数のP. aeruginosa,やS. marcescensが院内感染起因菌として分離されている。さらに,その後,Alcaligenes xylosoxidansやP. putidaあるいはKlebsiella pneumoniaeなどにもこの酵素を産生する株が見つかっている3)(図3)。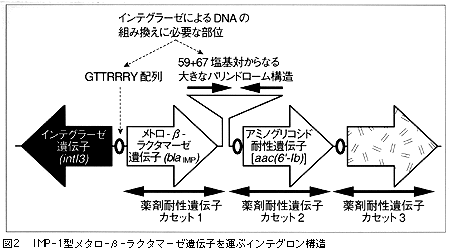
おわりに
プラスミド依存性にメタロ-β-ラクタマーゼを産生するカルバペネム耐性P. aeruginosaやS. marcescensなどが,全国各地の医療施設から分離されている。将来,この種の耐性菌がさらに蔓延した場合,それらによる院内感染症に対し,カルバペネムを含むすべてのβ-ラクタム薬が効かなくなることを意味し,抗菌薬の選択の幅が著しく狭められることになる。したがって,今後のこの種の耐性菌の分離動向に特に注意を払いつつ,本格的な対策を立てなければならない時期に来ているといえるであろう。参考文献
1)Osano E., Y. Arakawa, R. Wacharotayankun, et al.: Molecular characterization of an enterobacterial metallo β-lactamase found in a clinical isolate of Serratia marcescens that shows imipenem resistance. Antimicrob. Agents Chemother., 38: 71-78, 1994
2)Watanabe M., S. Iyobe, M. Inoue, et al.: Transferable imipenem resistance in Pseudomonas aeruginosa. Antimicrob. Agents Chemother., 35:147-151, 1991
3)Senda K., Y. Arakawa, S. Ichiyama, et al.: PCR detection of metallo-β-lactamase gene(blaIMP)in gram‐negative rods resistant to broad‐spectrum β-lactams. J. Clinic. Microbiol., 34: 2909-2913, 1996
