連載
脳腫瘍
発生要因から遺伝子治療まで(6)
脳の機能領野の確定とその手術への応用
中里信和(東北大学・脳神経外科)はじめに
大脳皮質には部位別に異なった機能が存在する。脳回・脳溝などの解剖構造から機能局在を推定することはある程度は可能だが,健常人でも性差・個人差がある上,頭蓋内・脳内に病変がある場合には脳機能の部分的障害や機能局在の偏位が生じる可能性もある。脳腫瘍の外科治療に際しては,神経脱落症状をなるべく起こしにくいアプローチや切除範囲を選択することが重要である。そこで,術後の機能障害を最小限としつつ最大の手術効果を得るためには,個々の症例に応じた脳の機能マッピングが必要となる。脳機能マッピングの手法としては,脳表電気刺激,脳表記録誘発電位,ポジトロン断層撮影(PET),機能的MRI(fMRI),頭皮上記録誘発電位,誘発脳磁図などがある。本稿で紹介する誘発脳磁図は,完全に非侵襲的で時間分解能・空間分解能の両者に優れた脳機能検査法である。脳腫瘍の診断治療における誘発脳磁図の有用性について紹介したい。
脳磁図の原理と計測
 脳磁図(magnetoencephalography:MEG)は,脳の神経活動に伴って頭皮上で観察される微弱な磁界である。MEGでは脳波と同様に,神経細胞の電気活動をミリ秒単位で観察できる。しかも,頭蓋骨や髄液などによる頭部導電率不均一性によって信号が歪められず,脳波に比べ高い信号源推定精度を有する。
脳磁図(magnetoencephalography:MEG)は,脳の神経活動に伴って頭皮上で観察される微弱な磁界である。MEGでは脳波と同様に,神経細胞の電気活動をミリ秒単位で観察できる。しかも,頭蓋骨や髄液などによる頭部導電率不均一性によって信号が歪められず,脳波に比べ高い信号源推定精度を有する。
MEGの存在は1968年にCohenによって確認され,1972年には超伝導量子干渉素子(SQUID)を用いたMEG計測が行なわれた。SQUIDは超伝導で作動する磁気センサであり,液体ヘリウム温度下に置く必要がある。
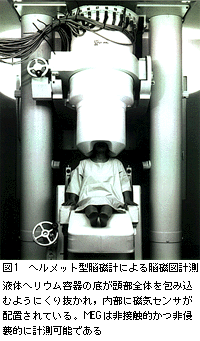
図1に示すヘルメット型脳磁計では,頭部全体のMEGを完全に非侵襲的に計測することが可能である。MEGの解析は個々の症例ごとのMR解剖画像と合わせて行なわれ,頭部のどの位置に信号源が存在するのかを,MEGデータに基づいて推定する。得られた結果は再びMR画像上に表示される。被験者に種々の感覚刺激を与えることにより誘発されるMEGを計測すると,以下で述べる体性感覚野,聴覚野,視覚野などの同定が可能となる。
体性感覚誘発磁界
中心溝の前後には一次運動野と一次感覚野が存在し,それぞれ身体部位に応じた細かな機能局在分布を持つ。特に四肢領域の大脳皮質傷害は対側の運動麻痺および感覚障害を引き起こすため,中心溝の同定は脳機能マッピングの基本ともいえる。
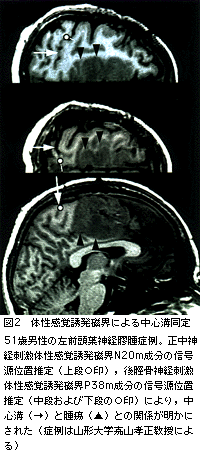
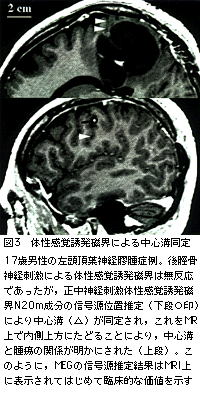
中心溝同定には体性感覚誘発磁界(somatosensory evoked field:SEF)が有用である。正中神経や後脛骨神経の電気刺激において,それぞれ潜時約20msおよび40msの反応起源を求めることにより,中心溝の後壁が同定できる(図2,図3)。
SEFの特徴の第1は,完全に非侵襲的であり脳表を露出する操作が不要という点である。術中の中心溝同定法とは異なり,SEFはくり返し計測が可能で,開頭術以外の症例にも応用可能である。
第2に,中心溝同定の精度が2-3mmと高い点があげられる。過去の開頭術の影響で頭蓋に部分欠損があってもSEFの高い精度は保たれる。頭皮上記録の体性感覚誘発電位に比べて特に有利な点である。
第3に,意識障害者においても中心溝が同定できる点があげられる。fMRIやPETにおける運動賦活による中心溝同定法では,患者の協力が不可欠であり意識障害患者では中心溝同定は困難である。
第4に,四肢の感覚障害が高度でSEFが無反応な例を除けば,ほぼ全例で中心溝が同定できる点である。感覚障害の程度によっては,SEF反応の潜時延長,振幅低下,時には振幅増大などの所見が出現するが,いずれの場合でも得られる信号源位置による中心溝同定は可能である。
第5に,SEFでは様々な身体部位に応じた感覚野の同定が可能である。手指別刺激SEFの信号源位置は,中心溝後壁に沿って拇指から小指まで順に前下外側から後上内側に配列する。また,舌・口唇による中心溝同定も可能であり,シルヴィウス裂よりの中心溝を同定できる。逆に,背側陰部神経刺激では,大脳半球間裂に面した中心溝が同定できる。
こうして得られた一次感覚野の分布図は,脳腫瘍の摘出術に対するアプローチ決定の際に有用な情報を提供する。特に四肢の運動・感覚野の機能温存は,腫瘍の良性・悪性を問わず重要である。一方で,口唇・舌などの運動・感覚野であれば,一側半球の部分的な障害があっても両側性の神経支配のために機能障害は最小限で済み,症例によっては皮質切開が加えられることも許されよう。
聴覚誘発磁界
聴覚野は左右両側に存在する。聴覚誘発磁界(auditory evoked field:AEF)の大脳半球成分は,左右いずれの耳刺激でも両側性であり,信号源はシルヴィウス裂下面,両側側頭葉上面の後部に推定される。同様の刺激による頭皮上記録の聴覚誘発電位では,前頭頭頂部を中心とした広範な電位分布が出現するのみであり,左右聴覚野の活動を分離することは難しい。一方AEFでは左右の半球活動の分離は明白であり,臨床応用上極めて好都合である。AEFの代表的な成分であるN100m反応においては,いくつかの大脳半球較差が知られている。すなわち,刺激耳に対する対側反応は同側反応に比べて潜時が短く振幅が大きいが,加えて右半球では左半球に比べて潜時が短く振幅で大きい。つまり右半球が優位であると考えられる。右利き男性におけるN100m信号源は,右半球では左半球よりも前方に存在する。女性ではこの差は小さい。
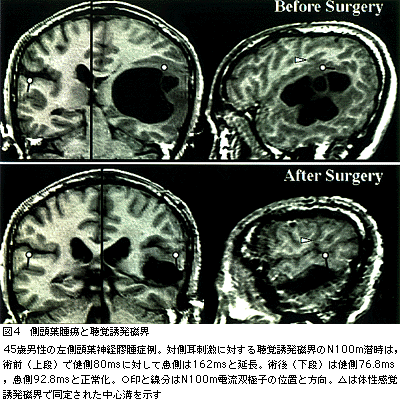
一側の側頭葉が障害されても一般的な聴力異常は検出されないが,患側半球由来のAEF反応には潜時遅延・振幅低下・波形消失などの異常所見が明瞭に出現する。これまでの研究から,側頭葉腫瘍において,腫瘍そのものや周囲の浮腫が側頭葉上面後部に浸潤している場合には,患側由来のN100m反応が消失したり潜時が延長することが示されている(図4)。こうした臨床研究はまだ始まったばかりであるが,脳腫瘍の治療を考える上で特定の大脳皮質機能の残存を病変の消長と対応して検討できる有用性は大きいと考える。
後頭葉視覚野の機能解剖
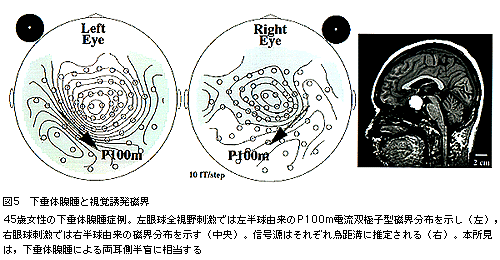
視覚誘発磁界(visual evoked field:VEF)では,反応の信号起源が確定していなかったために,臨床応用が遅れていた。パターン反転刺激視覚誘発電位のP100成分の起源に関しては一次視覚野の有線領とする意見と有線領外とする意見が対立しており,VEFでも同様の議論が繰り返されてきた。しかし,最近の研究では,パターン反転刺激VEFにおいて,左右半視野刺激と1/4視野刺激によるP100m成分を比較した結果,P100mの磁界分布・信号源位置・電流方向には差がないことが示された。信号源はいずれも烏距溝外側端の限局した部位にあることが判明している。さらに最近,全視野刺激VEFにおいても左右の後頭葉の反応を分離して解析可能であることが見出された。全視野刺激による視覚誘発電位では,両側後頭葉由来の信号が後頭正中部で重なり合い,反応を分離することが困難とされている。一方VEFでは,全視野刺激でも明確に左右の磁界分布を識別可能であるため,被験者に厳密な固視を強制する必要もなく,臨床応用上きわめて有用である。これまでに,後頭葉腫瘍や下垂体部腫瘍によるさまざまな視野狭窄症例においてVEFが計測されている(図5)。